Chủ đề vẽ sơ đồ cấu tạo nguyên tử oxygen: Vẽ sơ đồ cấu tạo nguyên tử oxygen là một bước quan trọng để hiểu rõ hơn về cấu trúc của nguyên tố này. Bài viết này sẽ cung cấp cho bạn hướng dẫn chi tiết từng bước, từ cơ bản đến nâng cao, giúp bạn dễ dàng nắm bắt kiến thức về cấu trúc và vai trò của oxygen trong các phản ứng hóa học và sinh học.
Mục lục
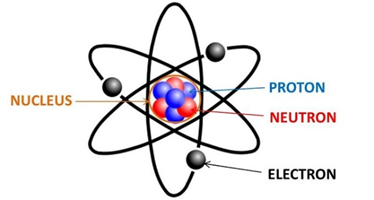
Sơ Đồ Cấu Tạo Nguyên Tử Oxygen
Nguyên tử Oxygen, hay còn gọi là nguyên tố oxy, là một nguyên tố hóa học với ký hiệu O và số nguyên tử 8. Oxygen là một trong những nguyên tố phổ biến nhất trong vũ trụ và đóng vai trò quan trọng trong quá trình hô hấp của các sinh vật sống. Sơ đồ cấu tạo của nguyên tử oxygen giúp chúng ta hiểu rõ hơn về cấu trúc và cách thức hoạt động của nó.
Cấu Trúc Nguyên Tử Oxygen
Một nguyên tử oxygen bao gồm:
- Hạt nhân: Bao gồm 8 proton và 8 neutron.
- Vỏ electron: Có 8 electron được sắp xếp trong hai lớp vỏ electron. Lớp vỏ thứ nhất có 2 electron, và lớp vỏ thứ hai có 6 electron.
Sơ Đồ Bohr của Nguyên Tử Oxygen
Sơ đồ Bohr biểu diễn cách sắp xếp các electron xung quanh hạt nhân của nguyên tử oxygen.
- Lớp vỏ thứ nhất: \(2e^{-}\)
- Lớp vỏ thứ hai: \(6e^{-}\)
Ta có thể biểu diễn sơ đồ Bohr của nguyên tử oxygen như sau:
\[ \text{O:} \quad \text{2e}^{-} \, \bigcirc \, \text{6e}^{-} \]
Mô Hình Sơ Đồ Lewis của Nguyên Tử Oxygen
Sơ đồ Lewis biểu diễn các electron hóa trị của nguyên tử oxygen. Do oxygen có 6 electron hóa trị, sơ đồ Lewis của nó sẽ có 6 dấu chấm xung quanh ký hiệu O.
\[ \text{O} \, : \, \cdot \cdot \, \cdot \cdot \, \cdot \cdot \]
Ứng Dụng và Tầm Quan Trọng của Nguyên Tử Oxygen
- Trong hóa học: Oxygen là một chất oxi hóa mạnh, tham gia vào nhiều phản ứng hóa học quan trọng, như phản ứng đốt cháy.
- Trong sinh học: Oxygen là yếu tố cần thiết cho quá trình hô hấp tế bào, cung cấp năng lượng cho các sinh vật sống.
- Trong công nghiệp: Oxygen được sử dụng trong cắt kim loại, hàn xì, và làm nhiên liệu cho tên lửa.
Tóm Lược
Hiểu rõ về cấu trúc nguyên tử oxygen không chỉ giúp chúng ta nắm bắt kiến thức cơ bản về hóa học mà còn giúp ứng dụng vào nhiều lĩnh vực khác nhau như sinh học, công nghiệp và công nghệ môi trường.

.png)
1. Giới Thiệu Về Nguyên Tử Oxygen
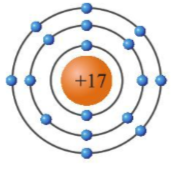
Nguyên tử oxygen, hay còn gọi là nguyên tử oxy, là một trong những nguyên tố hóa học quan trọng nhất trong bảng tuần hoàn. Oxygen có ký hiệu hóa học là O và có số nguyên tử là 8, nghĩa là nó có 8 proton trong hạt nhân và 8 electron quay quanh hạt nhân. Nguyên tử oxygen đóng vai trò quan trọng trong nhiều phản ứng hóa học, đặc biệt là các phản ứng liên quan đến sự sống và môi trường.
Oxygen là nguyên tố phổ biến thứ ba trong vũ trụ theo khối lượng, sau hydrogen và helium, và chiếm khoảng 21% thể tích của khí quyển Trái Đất. Oxygen tồn tại chủ yếu dưới dạng phân tử diatomic \((O_2)\), nhưng cũng có thể tồn tại dưới dạng phân tử triatomic \((O_3)\), được gọi là ozone.
Nguyên tử oxygen có cấu hình electron là \(1s^2 2s^2 2p^4\). Điều này có nghĩa là nó có hai electron trong lớp vỏ đầu tiên (1s) và sáu electron trong lớp vỏ thứ hai (2s và 2p). Cấu hình này làm cho oxygen rất phản ứng, vì nó cần thêm hai electron để hoàn thành lớp vỏ ngoài cùng và đạt đến trạng thái ổn định giống như khí hiếm neon.
- Tầm quan trọng của Oxygen: Oxygen là thành phần cơ bản của các hợp chất hữu cơ và vô cơ, và cần thiết cho quá trình hô hấp của hầu hết các sinh vật sống.
- Cấu trúc nguyên tử: Oxygen có 8 proton và neutron trong hạt nhân, và 8 electron quay xung quanh hạt nhân, phân bố theo cấu hình electron.
- Tính chất hóa học: Oxygen có tính oxy hóa mạnh, dễ dàng tham gia vào các phản ứng hóa học để tạo ra oxit, đặc biệt là trong quá trình cháy và hô hấp.
Oxygen là nguyên tố cần thiết cho sự sống và đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học. Hiểu biết về cấu trúc và tính chất của nguyên tử oxygen giúp chúng ta nắm bắt được các cơ chế quan trọng trong hóa học và sinh học, từ sự cháy nổ, hô hấp đến bảo vệ môi trường và sức khỏe con người.
2. Cấu Trúc Nguyên Tử Oxygen
Nguyên tử oxygen là một trong những nguyên tố hóa học cơ bản có cấu trúc đơn giản nhưng đóng vai trò quan trọng trong nhiều phản ứng hóa học. Để hiểu rõ hơn về cấu trúc của nguyên tử oxygen, chúng ta cần xem xét các thành phần chính cấu thành nên nó, bao gồm hạt nhân (proton và neutron) và lớp vỏ electron.
Các Thành Phần Cơ Bản Của Nguyên Tử Oxygen
- Hạt nhân: Hạt nhân của nguyên tử oxygen bao gồm 8 proton mang điện tích dương và thường có 8 neutron không mang điện tích. Tổng số hạt trong hạt nhân gọi là số khối, và đối với oxygen thông thường, số khối là 16 \((8 \, \text{proton} + 8 \, \text{neutron})\).
- Electron: Xung quanh hạt nhân là 8 electron mang điện tích âm. Các electron này phân bố trong các lớp vỏ electron, tạo thành cấu hình electron cho nguyên tử.
Sơ Đồ Phân Bố Electron Trong Nguyên Tử Oxygen
Các electron trong nguyên tử oxygen được phân bố vào các lớp năng lượng khác nhau theo thứ tự tăng dần của năng lượng. Sơ đồ phân bố electron của oxygen được viết là \(1s^2 2s^2 2p^4\). Điều này có nghĩa là:
- Lớp vỏ thứ nhất (n = 1): Có 2 electron trong orbital 1s.
- Lớp vỏ thứ hai (n = 2): Có 2 electron trong orbital 2s và 4 electron trong orbital 2p.
Việc hiểu rõ cách phân bố electron này giúp chúng ta thấy được lý do vì sao oxygen có khả năng phản ứng mạnh. Với 6 electron ở lớp vỏ ngoài cùng, oxygen có xu hướng thu thêm 2 electron để đạt cấu hình ổn định giống khí hiếm neon.
Sơ Đồ Cấu Tạo Nguyên Tử Oxygen
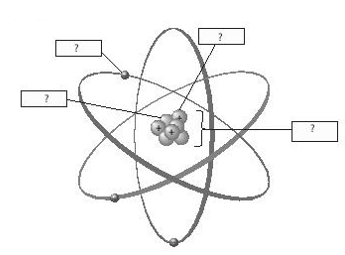
Một sơ đồ đơn giản về cấu tạo nguyên tử oxygen bao gồm:
- Hạt nhân: Vị trí trung tâm với 8 proton và 8 neutron.
- Lớp vỏ thứ nhất (n = 1): Vòng tròn gần hạt nhân chứa 2 electron.
- Lớp vỏ thứ hai (n = 2): Vòng tròn xa hơn chứa 6 electron, trong đó có 2 electron nằm ở orbital 2s và 4 electron ở orbital 2p.
| Thành phần | Số lượng | Điện tích |
|---|---|---|
| Proton | 8 | +1 |
| Neutron | 8 | 0 |
| Electron | 8 | -1 |
Sự phân bố này tạo ra cấu trúc bền vững cho nguyên tử oxygen và cho phép nó tham gia vào nhiều phản ứng hóa học khác nhau, bao gồm phản ứng oxy hóa-khử và sự hình thành các hợp chất như nước \((H_2O)\) và carbon dioxide \((CO_2)\).

3. Các Mô Hình Biểu Diễn Nguyên Tử Oxygen
Nguyên tử oxygen có thể được biểu diễn bằng nhiều mô hình khác nhau để giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của nó. Dưới đây là ba mô hình phổ biến được sử dụng để biểu diễn nguyên tử oxygen:
Mô Hình Bohr
Mô hình Bohr là một trong những mô hình đầu tiên được sử dụng để biểu diễn nguyên tử. Theo mô hình này, các electron quay xung quanh hạt nhân theo các quỹ đạo hình tròn ở những khoảng cách xác định. Đối với nguyên tử oxygen:
- Hạt nhân: Bao gồm 8 proton và 8 neutron.
- Lớp vỏ electron: Có 2 lớp. Lớp thứ nhất chứa 2 electron, và lớp thứ hai chứa 6 electron.
Sơ đồ này đơn giản và giúp chúng ta dễ dàng hình dung cấu trúc cơ bản của nguyên tử oxygen. Tuy nhiên, mô hình Bohr không thể hiện được hình dạng thực tế và chuyển động phức tạp của các electron trong không gian ba chiều.
Mô Hình Đám Mây Electron
Mô hình đám mây electron là mô hình hiện đại hơn so với mô hình Bohr, biểu diễn các electron dưới dạng các đám mây xác suất bao quanh hạt nhân. Trong mô hình này, vị trí của mỗi electron không được xác định chính xác mà chỉ có thể xác định theo xác suất:
- Đám mây 1s: Gần hạt nhân nhất và chứa 2 electron. Đám mây này có hình cầu xung quanh hạt nhân.
- Đám mây 2s và 2p: Lớp tiếp theo có 2 electron trong đám mây 2s (cũng có hình cầu) và 4 electron trong ba đám mây 2p có hình dạng hoa thị (hình số tám).
Mô hình này cho phép hiểu rõ hơn về sự phân bố electron xung quanh hạt nhân và cách chúng tham gia vào các liên kết hóa học, nhưng nó cũng phức tạp hơn và yêu cầu kiến thức về cơ học lượng tử để giải thích đầy đủ.
Mô Hình Orbital Nguyên Tử
Mô hình orbital nguyên tử là sự mở rộng của mô hình đám mây electron, sử dụng các hàm sóng để mô tả vùng không gian mà các electron có khả năng xuất hiện. Mỗi electron trong nguyên tử oxygen có một orbital riêng biệt:
- Orbital 1s: Có 2 electron với hình dạng hình cầu, nằm rất gần hạt nhân.
- Orbital 2s: Có 2 electron với hình dạng hình cầu lớn hơn và nằm ở lớp vỏ thứ hai.
- Orbital 2p: Có 4 electron phân bố vào ba orbital p (\(p_x, p_y, p_z\)) với hình dạng số tám nằm trong không gian ba chiều.
Mô hình orbital nguyên tử giúp hiểu sâu hơn về liên kết hóa học và phản ứng của nguyên tử oxygen, đặc biệt là trong các hợp chất hóa học như nước (\(H_2O\)) và carbon dioxide (\(CO_2\)). Mô hình này là cơ sở cho nhiều ứng dụng trong hóa học và vật lý nguyên tử.
| Mô Hình | Đặc Điểm Chính |
|---|---|
| Mô Hình Bohr | Electron quay quanh hạt nhân theo quỹ đạo cố định. |
| Mô Hình Đám Mây Electron | Electron được biểu diễn bằng các đám mây xác suất bao quanh hạt nhân. |
| Mô Hình Orbital Nguyên Tử | Sử dụng các hàm sóng để mô tả vùng không gian của electron. |
Các mô hình này đều có ưu điểm và hạn chế riêng, nhưng đều giúp chúng ta hiểu rõ hơn về nguyên tử oxygen và vai trò của nó trong các phản ứng hóa học.
4. Ứng Dụng Của Oxygen Trong Hóa Học
Oxygen là một nguyên tố hóa học quan trọng có nhiều ứng dụng trong hóa học. Với tính chất hoạt động mạnh và khả năng tạo liên kết với hầu hết các nguyên tố khác, oxygen đóng vai trò thiết yếu trong nhiều phản ứng hóa học. Dưới đây là một số ứng dụng phổ biến của oxygen trong lĩnh vực hóa học:
4.1. Ứng Dụng Trong Phản Ứng Oxi Hóa - Khử
Oxygen đóng vai trò quan trọng trong các phản ứng oxi hóa - khử, nơi nó thường hoạt động như một chất oxi hóa mạnh:
- Phản ứng oxi hóa kim loại: Oxygen phản ứng với kim loại để tạo ra oxit kim loại, ví dụ như phản ứng giữa oxygen và sắt để tạo ra gỉ sắt (\(Fe_2O_3\)).
- Phản ứng đốt cháy: Oxygen là yếu tố chính trong các phản ứng đốt cháy. Các hợp chất hữu cơ như hydrocarbon phản ứng với oxygen để tạo ra carbon dioxide (\(CO_2\)) và nước (\(H_2O\)), giải phóng năng lượng dưới dạng nhiệt và ánh sáng.
4.2. Ứng Dụng Trong Sản Xuất Hóa Chất
Oxygen được sử dụng rộng rãi trong sản xuất hóa chất, đặc biệt là trong các quá trình công nghiệp:
- Sản xuất axit sulfuric (\(H_2SO_4\)): Oxygen được sử dụng trong quá trình chuyển đổi lưu huỳnh dioxide (\(SO_2\)) thành lưu huỳnh trioxide (\(SO_3\)), bước quan trọng trong sản xuất axit sulfuric.
- Sản xuất ethylene oxide: Oxygen phản ứng với ethylene (\(C_2H_4\)) để tạo ra ethylene oxide (\(C_2H_4O\)), một hợp chất trung gian quan trọng trong sản xuất polyethylen glycol và các chất hoạt động bề mặt.
4.3. Ứng Dụng Trong Quá Trình Lọc Không Khí Và Nước
Oxygen được sử dụng để cải thiện chất lượng không khí và nước trong các hệ thống xử lý môi trường:
- Lọc không khí: Oxygen giúp phá vỡ các chất hữu cơ và hóa chất độc hại trong không khí thông qua các phản ứng oxi hóa, giảm ô nhiễm môi trường.
- Lọc nước: Trong các hệ thống xử lý nước thải, oxygen được sử dụng để oxi hóa các chất hữu cơ và vô cơ có hại, cải thiện chất lượng nước.
4.4. Ứng Dụng Trong Quá Trình Tổng Hợp Hóa Học
Oxygen được sử dụng trong nhiều quá trình tổng hợp hóa học để tạo ra các hợp chất mới:
- Tổng hợp hóa học hữu cơ: Oxygen được sử dụng trong nhiều phản ứng tổng hợp hữu cơ, bao gồm các phản ứng oxi hóa alcol, aldehyde và axit carboxylic.
- Quá trình hóa học vô cơ: Oxygen đóng vai trò trong tổng hợp các hợp chất vô cơ, như oxit kim loại và các hợp chất oxy hóa khác.
| Ứng Dụng | Chi Tiết |
|---|---|
| Phản ứng oxi hóa - khử | Oxi hóa kim loại, đốt cháy hydrocarbon, sản xuất năng lượng. |
| Sản xuất hóa chất | Sản xuất axit sulfuric, ethylene oxide và các hợp chất hóa học khác. |
| Xử lý môi trường | Lọc không khí và nước, cải thiện chất lượng môi trường. |
| Tổng hợp hóa học | Sản xuất hợp chất hữu cơ và vô cơ, ứng dụng trong nhiều ngành công nghiệp. |
Nhờ vào khả năng hoạt động hóa học mạnh mẽ và tính chất dễ dàng kết hợp với các nguyên tố khác, oxygen trở thành một thành phần không thể thiếu trong nhiều quá trình hóa học. Ứng dụng của nó không chỉ giới hạn trong phòng thí nghiệm mà còn mở rộng ra nhiều ngành công nghiệp và lĩnh vực khác nhau.

5. Oxygen và Quá Trình Hô Hấp Sinh Học
Oxygen đóng vai trò quan trọng trong quá trình hô hấp sinh học, một quá trình thiết yếu giúp các sinh vật sống chuyển hóa năng lượng từ các phân tử thức ăn thành năng lượng hóa học cần thiết cho hoạt động sống. Quá trình hô hấp sinh học diễn ra chủ yếu trong tế bào, đặc biệt là trong ty thể, nơi oxygen tham gia vào việc chuyển hóa glucose thành năng lượng dưới dạng ATP (Adenosine Triphosphate).
5.1. Giai Đoạn Của Quá Trình Hô Hấp Sinh Học
Quá trình hô hấp sinh học bao gồm ba giai đoạn chính:
- Đường phân (Glycolysis): Quá trình này diễn ra trong tế bào chất, nơi glucose (\(C_6H_{12}O_6\)) bị phân giải thành hai phân tử pyruvate, đồng thời sản sinh ra một lượng nhỏ ATP và NADH.
- Chu trình Krebs (Chu trình Acid Citric): Trong ty thể, pyruvate bị chuyển hóa thêm để sản sinh ra CO2, NADH, FADH2, và một lượng nhỏ ATP. Đây là giai đoạn trung tâm của quá trình hô hấp, nơi các phân tử mang năng lượng được tạo ra.
- Chuỗi chuyền điện tử (Electron Transport Chain - ETC): Oxygen đóng vai trò là chất nhận điện tử cuối cùng trong chuỗi chuyền điện tử, giúp tổng hợp một lượng lớn ATP từ ADP bằng cách sử dụng năng lượng từ các điện tử được chuyển qua chuỗi ETC. Oxygen kết hợp với các điện tử và ion hydrogen để tạo ra nước (\(H_2O\)).
5.2. Vai Trò Của Oxygen Trong Chuỗi Chuyền Điện Tử
Trong chuỗi chuyền điện tử, oxygen là chất nhận điện tử cuối cùng. Khi các điện tử đi qua các phức hợp protein trong màng ty thể, chúng tạo ra một gradient proton, tạo điều kiện cho quá trình tổng hợp ATP:
- Oxygen nhận điện tử và proton từ phức hợp cuối cùng của chuỗi chuyền điện tử để tạo thành nước (\(2H^+ + 2e^- + 1/2 O_2 \rightarrow H_2O\)).
- Quá trình này giúp duy trì dòng điện tử và tạo ra năng lượng cần thiết để bơm proton qua màng ty thể, tạo ra gradient proton.
- Gradient proton này cung cấp năng lượng cho ATP synthase, enzyme tổng hợp ATP từ ADP và phosphate vô cơ (Pi).
5.3. Ý Nghĩa Sinh Học Của Oxygen Trong Hô Hấp
Oxygen không chỉ là thành phần thiết yếu của không khí mà còn là yếu tố quan trọng trong quá trình sinh học của mọi sinh vật hiếu khí. Vai trò của oxygen trong quá trình hô hấp sinh học bao gồm:
- Chuyển hóa năng lượng: Oxygen giúp tối đa hóa việc sản xuất ATP từ glucose, cung cấp năng lượng cần thiết cho các hoạt động tế bào.
- Điều hòa chuyển hóa: Mức độ oxygen trong cơ thể có thể ảnh hưởng đến các quá trình chuyển hóa, giúp cơ thể điều chỉnh theo nhu cầu năng lượng thay đổi.
- Bảo vệ tế bào: Việc thiếu oxygen có thể dẫn đến tổn thương tế bào và mô do tích lũy lactate và các sản phẩm phụ khác của quá trình chuyển hóa kỵ khí.
5.4. Quá Trình Hô Hấp Kỵ Khí Khi Thiếu Oxygen
Khi thiếu oxygen, các tế bào sẽ chuyển sang hô hấp kỵ khí, một quá trình tạo ra năng lượng ít hiệu quả hơn và tạo ra acid lactic:
- Hô hấp kỵ khí chỉ tạo ra 2 ATP từ mỗi phân tử glucose, so với 36-38 ATP từ hô hấp hiếu khí.
- Sự tích lũy acid lactic trong cơ bắp dẫn đến mệt mỏi và đau nhức.
Nhờ vai trò không thể thiếu của oxygen trong quá trình hô hấp sinh học, các sinh vật hiếu khí có thể tận dụng hiệu quả nguồn năng lượng từ thực phẩm, duy trì sự sống và hoạt động trong môi trường giàu oxygen.
XEM THÊM:
6. Cách Vẽ Sơ Đồ Cấu Tạo Nguyên Tử Oxygen
Để vẽ sơ đồ cấu tạo nguyên tử Oxygen, bạn cần nắm rõ các bước cơ bản sau đây. Sơ đồ này giúp bạn hình dung rõ hơn về cấu trúc của nguyên tử Oxygen, bao gồm các electron, proton và neutron. Dưới đây là hướng dẫn chi tiết cách vẽ sơ đồ cấu tạo nguyên tử Oxygen theo các mô hình phổ biến như Bohr và Lewis.
6.1. Các Bước Vẽ Sơ Đồ Bohr
- Xác định số lượng proton và neutron trong hạt nhân của nguyên tử Oxygen:
- Oxygen có số hiệu nguyên tử là 8, nghĩa là có 8 proton trong hạt nhân.
- Oxygen thông thường có 8 neutron trong hạt nhân.
- Vẽ hạt nhân ở trung tâm và ghi chú số lượng proton và neutron.
- Xác định số lượng electron và sắp xếp chúng vào các lớp vỏ electron:
- Nguyên tử Oxygen có 8 electron.
- Electron sẽ được phân bố vào các lớp vỏ theo quy tắc: lớp thứ nhất chứa tối đa 2 electron, lớp thứ hai chứa tối đa 6 electron.
- Vẽ các lớp vỏ electron và sắp xếp electron vào từng lớp:
- Lớp vỏ thứ nhất: 2 electron.
- Lớp vỏ thứ hai: 6 electron.
6.2. Hướng Dẫn Vẽ Sơ Đồ Lewis
- Xác định số electron ở lớp vỏ ngoài cùng của nguyên tử Oxygen:
- Oxygen có 6 electron ở lớp vỏ ngoài cùng.
- Vẽ ký hiệu hóa học của nguyên tử Oxygen (O) ở trung tâm.
- Vẽ các dấu chấm xung quanh ký hiệu để biểu diễn các electron ở lớp vỏ ngoài cùng:
- Bắt đầu vẽ các dấu chấm xung quanh ký hiệu O, mỗi dấu chấm tượng trưng cho một electron.
- Sắp xếp các dấu chấm sao cho chúng không tạo thành các cặp ngay lập tức, nghĩa là vẽ mỗi electron vào mỗi góc trước khi ghép đôi chúng.
6.3. Công Cụ và Phần Mềm Hỗ Trợ Vẽ Sơ Đồ Nguyên Tử
- ChemSketch: Một phần mềm hữu ích cho việc vẽ các sơ đồ hóa học, bao gồm cả sơ đồ cấu tạo nguyên tử.
- MolView: Một công cụ trực tuyến cho phép vẽ sơ đồ nguyên tử và mô hình phân tử một cách trực quan.
- Phần mềm AutoCAD: Hỗ trợ vẽ các sơ đồ phức tạp với độ chính xác cao.

7. Các Bài Tập và Câu Hỏi Thực Hành
Để củng cố kiến thức về cấu tạo nguyên tử oxygen, dưới đây là một số bài tập và câu hỏi thực hành giúp bạn nắm vững hơn các khái niệm đã học:
-
Bài tập 1: Vẽ sơ đồ cấu tạo nguyên tử oxygen, chỉ rõ vị trí của các proton, neutron, và electron. Giải thích lý do tại sao electron quay quanh hạt nhân mà không bị hút vào hạt nhân.
Gợi ý: Sử dụng các thông tin đã học về lực hút giữa hạt nhân và electron để giải thích.
-
Bài tập 2: Xác định số lượng proton, neutron và electron trong một nguyên tử oxygen với số khối \(A = 16\) và số nguyên tử \(Z = 8\). Sau đó, tính khối lượng gần đúng của nguyên tử này.
- Số proton \(p = Z = 8\)
- Số neutron \(n = A - Z = 8\)
- Số electron \(e = Z = 8\)
Khối lượng nguyên tử gần đúng \[m = (Z \times m_p + n \times m_n)\]
-
Bài tập 3: Sử dụng công thức sau để tính bán kính quỹ đạo thứ nhất của electron trong nguyên tử oxygen:
\[r_1 = \frac{4\pi\epsilon_0\hbar^2}{me^2}\]
Trong đó: \(e\) là điện tích electron, \(m\) là khối lượng electron, \(\hbar\) là hằng số Planck giảm, và \(\epsilon_0\) là hằng số điện môi của chân không.
-
Bài tập 4: Giải thích tại sao nguyên tử oxygen được coi là trung hòa về điện mặc dù có sự hiện diện của các hạt mang điện tích khác nhau.
Gợi ý: Xem xét số lượng proton và electron trong nguyên tử oxygen.
Hãy thử sức với các bài tập trên và tự tin hơn khi tìm hiểu về cấu trúc nguyên tử!

8. Kết Luận
Qua các bước nghiên cứu và thực hành về cấu tạo nguyên tử oxygen, chúng ta đã hiểu rõ hơn về cách mà các hạt cơ bản như proton, neutron và electron được sắp xếp trong một nguyên tử. Điều này không chỉ giúp củng cố kiến thức về cấu trúc nguyên tử mà còn cung cấp nền tảng vững chắc cho việc nghiên cứu các phản ứng hóa học và các hiện tượng trong tự nhiên.
Việc vẽ sơ đồ cấu tạo nguyên tử oxygen và các nguyên tử khác đóng vai trò quan trọng trong việc hệ thống hóa và tổ chức kiến thức, giúp người học có cái nhìn trực quan hơn về các thành phần cấu tạo nguyên tử. Thông qua việc áp dụng các mô hình và sơ đồ, chúng ta có thể dễ dàng nhận biết và nắm bắt được mối liên hệ giữa các hạt bên trong nguyên tử.
Bên cạnh đó, bài học cũng đã chỉ ra rằng việc thực hành thông qua các bài tập và sơ đồ tư duy không chỉ giúp hiểu rõ hơn về lý thuyết mà còn nâng cao kỹ năng tư duy logic và khả năng giải quyết vấn đề trong hóa học. Đây là một phương pháp học tập hiệu quả, giúp người học không chỉ ghi nhớ kiến thức mà còn biết cách áp dụng chúng vào thực tế.
Kết luận, việc nắm vững cấu trúc và các nguyên lý cơ bản của nguyên tử sẽ tạo nền tảng vững chắc cho việc nghiên cứu sâu hơn trong các lĩnh vực hóa học khác nhau. Hãy tiếp tục luyện tập và khám phá thêm về thế giới vi mô để mở rộng kiến thức và tầm nhìn khoa học của bạn.