Chủ đề số hiệu nguyên tử của cl: Số hiệu nguyên tử của Clo là một khía cạnh quan trọng để hiểu về tính chất hóa học của nguyên tố này. Trong bài viết này, chúng ta sẽ khám phá chi tiết về Clo, từ số hiệu nguyên tử đến vai trò của nó trong công nghiệp và đời sống hàng ngày, cùng các ứng dụng an toàn của nó.
Mục lục
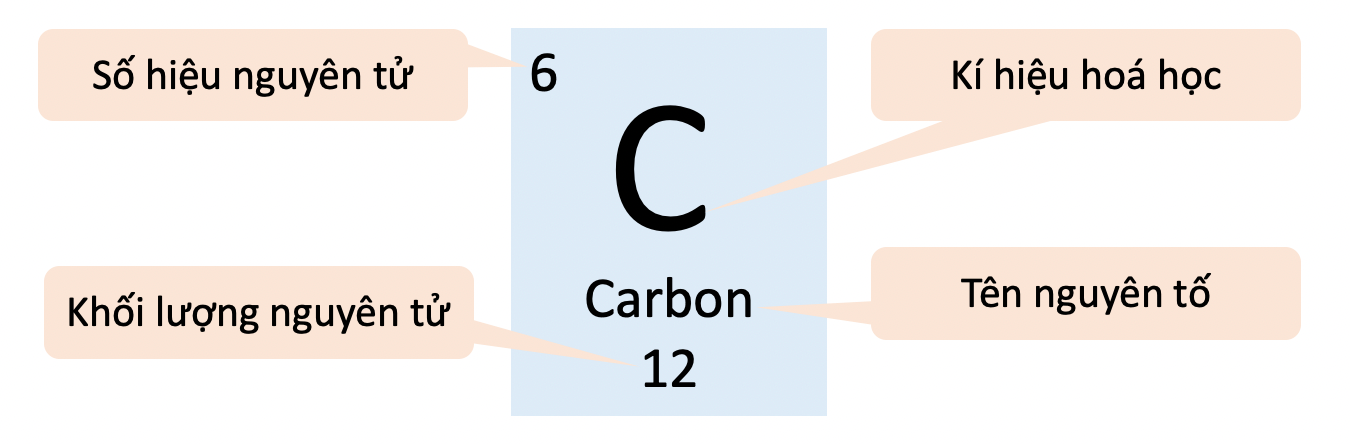
Số Hiệu Nguyên Tử Của Clo (Cl)
Số hiệu nguyên tử của Clo là 17. Điều này có nghĩa rằng trong mỗi nguyên tử Clo, có 17 proton trong hạt nhân. Clo là một nguyên tố hóa học thuộc nhóm halogen, có ký hiệu là Cl, và nằm ở vị trí thứ 17 trong bảng tuần hoàn các nguyên tố hóa học.
Tính Chất Vật Lý Của Clo (Cl)
- Clo là một chất khí màu vàng lục, có mùi xốc và rất độc.
- Clo nặng hơn không khí, tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt, và tan nhiều trong các dung môi hữu cơ.
- Trong tự nhiên, Clo tồn tại dưới dạng hai đồng vị bền là \(^ {35}\text{Cl}\) và \(^ {37}\text{Cl}\).
Tính Chất Hóa Học Của Clo
- Clo là một phi kim mạnh: Với lớp electron ngoài cùng có 7 electron, Clo có khả năng nhận thêm 1 electron để trở thành ion Cl\(^-\), thể hiện tính oxi hóa mạnh.
- Clo phản ứng với hầu hết các kim loại: Clo phản ứng với kim loại để tạo thành muối clorua. Ví dụ, phản ứng của Clo với nhôm tạo thành nhôm clorua: \[ 2Al + 3Cl_2 \rightarrow 2AlCl_3 \]
- Phản ứng với hiđro: Clo phản ứng với hiđro tạo thành hiđro clorua (HCl), có thể tồn tại ở dạng khí hoặc dung dịch. Phản ứng này mạnh hơn khi hỗn hợp Clo và hiđro có tỉ lệ 1:1. \[ Cl_2 + H_2 \rightarrow 2HCl \]
- Phản ứng với nước: Clo tác dụng với nước tạo ra axit clohiđric (HCl) và axit hipoclorơ (HClO), có tính oxi hóa mạnh: \[ Cl_2 + H_2O \rightleftharpoons HCl + HClO \]
Ứng Dụng Của Clo
- Clo được sử dụng rộng rãi trong công nghiệp để sản xuất các hợp chất hữu cơ và vô cơ, như axit clohiđric và thuốc tẩy.
- Clo cũng được dùng để khử trùng nước, xử lý nước thải, và trong sản xuất giấy và vải.
- Trong y tế, Clo là thành phần chính của nhiều loại thuốc sát khuẩn và thuốc tẩy trắng.
Lưu Ý Về An Toàn Khi Sử Dụng Clo
Clo là một chất khí rất độc, có thể gây hại nghiêm trọng cho sức khỏe con người nếu tiếp xúc trong thời gian dài. Hít phải Clo có thể gây kích ứng đường hô hấp, gây ra các vấn đề về phổi và thậm chí có thể dẫn đến tử vong.
| Tính Chất | Thông Tin |
| Số hiệu nguyên tử | 17 |
| Ký hiệu hóa học | Cl |
| Khối lượng nguyên tử | 35,5 |
| Cấu hình electron | \[1s^2 2s^2 2p^6 3s^2 3p^5\] |

.png)
1. Tổng Quan Về Số Hiệu Nguyên Tử Của Clo (Cl)
Số hiệu nguyên tử của Clo (ký hiệu hóa học là Cl) là 17. Điều này có nghĩa rằng trong mỗi nguyên tử Clo, có 17 proton trong hạt nhân. Đây là một đặc điểm quan trọng giúp xác định vị trí của Clo trong bảng tuần hoàn các nguyên tố hóa học.
Clo nằm trong nhóm halogen (nhóm VIIA) và có số nguyên tử đứng thứ 17. Clo là một nguyên tố phi kim, có đặc tính oxi hóa mạnh và tồn tại chủ yếu dưới dạng khí ở điều kiện thường. Clo cũng có hai đồng vị ổn định, \(^ {35}\text{Cl}\) và \(^ {37}\text{Cl}\), với tỉ lệ phân bố trong tự nhiên lần lượt là khoảng 75,77% và 24,23%.
Số hiệu nguyên tử không chỉ giúp phân loại và sắp xếp Clo trong bảng tuần hoàn mà còn ảnh hưởng trực tiếp đến các tính chất hóa học của nó. Với số hiệu nguyên tử là 17, Clo có khả năng nhận thêm một electron để đạt được cấu hình electron bền vững giống khí hiếm, dẫn đến tính chất oxi hóa mạnh mẽ.
Trong công nghiệp và đời sống, Clo được sử dụng rộng rãi trong việc khử trùng nước, sản xuất hóa chất và xử lý nước thải nhờ vào tính chất oxi hóa của nó. Sự hiểu biết về số hiệu nguyên tử của Clo giúp chúng ta khai thác và sử dụng hiệu quả nguyên tố này trong nhiều lĩnh vực khác nhau.
2. Vị Trí Của Clo Trong Bảng Tuần Hoàn
Clo (Cl) là nguyên tố hóa học thuộc nhóm Halogen trong bảng tuần hoàn, có số hiệu nguyên tử là 17. Nhóm Halogen là nhóm nguyên tố thuộc nhóm VIIA (hay nhóm 17) trong bảng tuần hoàn, và gồm các nguyên tố như: Flo (F), Clo (Cl), Brom (Br), Iot (I), và Astatine (At).
2.1. Vị Trí Nhóm Halogen
Nhóm Halogen nằm ở vị trí đặc biệt trong bảng tuần hoàn, là nhóm nằm gần cuối cùng của bảng, chỉ trước nhóm khí hiếm (nhóm VIII). Các nguyên tố trong nhóm Halogen đều có đặc điểm chung là có 7 electron ở lớp vỏ ngoài cùng, điều này làm cho chúng có xu hướng nhận thêm 1 electron để đạt được cấu hình bền vững tương tự như các khí hiếm. Clo (Cl) là một trong những nguyên tố có tính oxi hóa mạnh nhất trong nhóm này.
2.2. Đặc Điểm Cấu Trúc Nguyên Tử Clo
Nguyên tử Clo có cấu hình electron: \([Ne]3s^23p^5\). Với 7 electron ở lớp ngoài cùng, Clo có khả năng tham gia vào nhiều phản ứng hóa học để đạt cấu hình bền vững của khí hiếm bằng cách nhận thêm một electron. Điều này lý giải tại sao Clo, cùng với các nguyên tố khác trong nhóm Halogen, là những chất oxi hóa mạnh.
Trong bảng tuần hoàn, Clo nằm ở chu kỳ 3, có nghĩa là nó có ba lớp electron. Vị trí của Clo trong bảng tuần hoàn cũng giúp dự đoán tính chất hóa học của nó, như tính oxi hóa mạnh và khả năng phản ứng với nhiều nguyên tố khác.

3. Tính Chất Vật Lý Của Clo
Clo là một nguyên tố phi kim loại với những tính chất vật lý đặc trưng, thể hiện rõ ràng qua trạng thái tồn tại, màu sắc, và khả năng hòa tan trong nước. Dưới đây là những tính chất vật lý quan trọng của Clo:
3.1. Trạng Thái Tồn Tại Và Màu Sắc
Clo tồn tại dưới dạng khí ở điều kiện thường, có màu vàng lục đặc trưng và mùi hắc rất khó chịu. Trong trạng thái lỏng, Clo có màu vàng nhạt. Clo cũng dễ dàng hóa lỏng khi bị nén hoặc làm lạnh.
3.2. Khả Năng Hòa Tan Và Ứng Dụng Trong Công Nghiệp
- Khả năng hòa tan: Clo tan vừa phải trong nước, tạo ra dung dịch có tính axit nhẹ do sự tạo thành axit hypoclorơ \(\text{HClO}\) và axit clohydric \(\text{HCl}\).
- Ứng dụng trong công nghiệp: Nhờ tính chất khử mạnh và khả năng oxy hóa cao, Clo được sử dụng rộng rãi trong công nghiệp xử lý nước, sản xuất hóa chất và chất tẩy rửa, cũng như trong quy trình sản xuất nhựa PVC.
| Trạng Thái | Khí |
| Màu Sắc | Vàng lục |
| Nhiệt độ nóng chảy | -101°C |
| Nhiệt độ sôi | -34°C |
Clo có vai trò quan trọng trong nhiều lĩnh vực công nghiệp, đặc biệt là trong sản xuất các hợp chất hóa học và vật liệu. Tính chất vật lý đặc trưng của Clo đã làm cho nó trở thành một nguyên tố không thể thiếu trong nhiều quy trình sản xuất và ứng dụng thực tế.

4. Tính Chất Hóa Học Của Clo
Clo (Cl) là một nguyên tố hóa học thuộc nhóm halogen trong bảng tuần hoàn, có số hiệu nguyên tử là 17. Với đặc tính là một chất oxi hóa mạnh, Clo có khả năng tham gia nhiều phản ứng hóa học quan trọng, đặc biệt trong các lĩnh vực công nghiệp và sinh học.
Dưới đây là một số tính chất hóa học đặc trưng của Clo:
- Tác dụng với kim loại:
Clo phản ứng mạnh với hầu hết các kim loại để tạo thành muối clorua. Ví dụ:
- 2Al + 3Cl2 → 2AlCl3
- Tác dụng với phi kim:
Clo cũng phản ứng với một số phi kim như lưu huỳnh và photpho để tạo thành các hợp chất tương ứng. Ví dụ:
- S + Cl2 → SCl2
- P4 + 6Cl2 → 4PCl3
- Tác dụng với nước:
Khi tan trong nước, Clo tạo ra axit clohidric (HCl) và axit hipoclorơ (HClO), là một phản ứng thuận nghịch. Phương trình phản ứng:
- Cl2 + H2O ⇌ HCl + HClO
- Tác dụng với dung dịch kiềm:
Clo phản ứng với dung dịch kiềm như NaOH để tạo thành muối và nước. Ví dụ:
- Cl2 + 2NaOH → NaCl + NaClO + H2O
- Tác dụng với chất khử:
Clo có thể phản ứng với các chất khử mạnh để tạo ra các sản phẩm khác nhau. Ví dụ:
- Cl2 + 2FeCl2 → 2FeCl3
- 3Cl2 + 2NH3 → N2 + 6HCl
Các phản ứng hóa học của Clo không chỉ giúp chúng ta hiểu rõ hơn về tính chất của nguyên tố này, mà còn có ứng dụng rộng rãi trong nhiều lĩnh vực từ công nghiệp đến y tế.

5. Các Ứng Dụng Của Clo Trong Đời Sống
Clo là một nguyên tố hóa học có vai trò quan trọng trong nhiều lĩnh vực đời sống, từ công nghiệp cho đến sinh hoạt hàng ngày. Dưới đây là một số ứng dụng tiêu biểu của Clo:
- Khử trùng và xử lý nước: Clo được sử dụng rộng rãi trong việc khử trùng và làm sạch nước, đặc biệt trong hệ thống xử lý nước uống và nước thải. Nhờ tính chất oxi hóa mạnh, Clo giúp tiêu diệt vi khuẩn, virus và các vi sinh vật gây hại, đảm bảo an toàn vệ sinh cho nguồn nước.
- Sản xuất chất tẩy rửa: Clo là thành phần quan trọng trong các loại chất tẩy rửa và chất tẩy trắng, như nước Gia-ven \((Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O)\). Các chất này được sử dụng để tẩy trắng và làm sạch nhiều loại bề mặt, từ sàn nhà đến quần áo.
- Ngành công nghiệp giấy: Clo được dùng trong quá trình tẩy trắng bột giấy, giúp sản xuất ra giấy có độ trắng cao và đảm bảo vệ sinh, đặc biệt là trong các sản phẩm giấy tiêu dùng hàng ngày.
- Xử lý chất thải và y tế: Trong ngành y tế, Clo được sử dụng để khử trùng các dụng cụ y tế, bề mặt và nước, đảm bảo môi trường vô trùng trong các cơ sở y tế. Ngoài ra, Clo còn tham gia vào việc xử lý chất thải, giảm thiểu sự ô nhiễm môi trường do vi sinh vật gây ra.
- Bảo quản và chế biến thực phẩm: Clo được sử dụng để làm sạch các thiết bị trong quá trình sản xuất và chế biến thực phẩm, giúp bảo đảm an toàn vệ sinh thực phẩm, đồng thời kéo dài thời gian bảo quản thực phẩm.
- Hồ bơi: Một ứng dụng phổ biến của Clo là trong việc duy trì sự sạch sẽ và an toàn của nước hồ bơi. Clo giúp tiêu diệt vi khuẩn và các vi sinh vật có hại, giữ cho nước hồ bơi luôn trong và không gây hại cho sức khỏe người sử dụng.
Nhờ những ứng dụng đa dạng này, Clo đã trở thành một nguyên tố không thể thiếu trong nhiều lĩnh vực của đời sống, góp phần nâng cao chất lượng cuộc sống và bảo vệ sức khỏe cộng đồng.
XEM THÊM:
6. An Toàn Khi Sử Dụng Và Xử Lý Clo
Clo (Cl) là một nguyên tố quan trọng trong nhiều ngành công nghiệp, nhưng việc sử dụng và xử lý nó cần tuân thủ các biện pháp an toàn nghiêm ngặt để tránh các rủi ro tiềm tàng. Dưới đây là các bước và lưu ý quan trọng khi làm việc với clo:
- Bảo hộ lao động: Khi làm việc với clo, cần trang bị đầy đủ bảo hộ lao động bao gồm mặt nạ phòng độc, găng tay chống hóa chất, và áo bảo hộ. Điều này giúp bảo vệ người lao động khỏi các nguy cơ hít phải khí clo độc hại.
- Lưu trữ clo: Clo nên được lưu trữ trong các bình chứa chuyên dụng làm bằng vật liệu chống ăn mòn như thép không gỉ. Bình chứa cần được đặt ở nơi thoáng mát, tránh xa nguồn nhiệt và ánh nắng trực tiếp để giảm nguy cơ nổ hoặc rò rỉ khí.
- Xử lý sự cố rò rỉ: Trong trường hợp có rò rỉ khí clo, cần ngay lập tức sơ tán khu vực bị ảnh hưởng, thông gió để làm loãng khí độc, và sử dụng các chất khử độc như amoniac \((NH_3)\) để trung hòa khí clo.
- Biện pháp ứng phó khẩn cấp: Các cơ sở lưu trữ và sử dụng clo cần có kế hoạch ứng phó khẩn cấp rõ ràng, bao gồm việc đào tạo nhân viên về các biện pháp sơ cứu khi tiếp xúc với clo, và chuẩn bị các thiết bị cấp cứu như bình thở oxy và thuốc giải độc.
- Xử lý clo dư thừa: Clo dư thừa cần được xử lý bằng cách hòa tan vào nước để tạo thành axit clohidric \((HCl)\) và axit hipoclorơ \((HClO)\), sau đó tiếp tục xử lý hóa học để giảm thiểu tác động đến môi trường.
Việc tuân thủ các hướng dẫn an toàn khi sử dụng và xử lý clo không chỉ bảo vệ sức khỏe con người mà còn đảm bảo an toàn cho môi trường xung quanh.

7. Khám Phá Thêm Về Đồng Vị Của Clo
Clo là nguyên tố hóa học có hai đồng vị chính là \( ^{35}\text{Cl} \) và \( ^{37}\text{Cl} \). Hai đồng vị này chiếm tỷ lệ lần lượt là 75,77% và 24,23% trong tự nhiên. Sự tồn tại của các đồng vị này làm cho khối lượng nguyên tử trung bình của clo là khoảng 35,5 u.
Đồng vị \( ^{35}\text{Cl} \) và \( ^{37}\text{Cl} \) khác nhau về số neutron, điều này không chỉ ảnh hưởng đến khối lượng mà còn tác động đến các tính chất vật lý và hóa học của chúng. Trong các phản ứng hóa học thông thường, cả hai đồng vị này tham gia với mức độ tương đương, do đó sự khác biệt này thường không được chú ý trong các ứng dụng thực tế.
Trong nghiên cứu khoa học, việc phân tích tỉ lệ đồng vị của clo có thể cung cấp thông tin quý giá về các quá trình tự nhiên và nhân tạo. Ví dụ, tỉ lệ \( ^{37}\text{Cl} \) có thể được sử dụng để theo dõi nguồn gốc của các hợp chất clo trong môi trường hoặc để nghiên cứu các quá trình hóa học trong nước biển.
- Tính chất: Cả hai đồng vị đều có tính chất hóa học tương tự, nhưng khác biệt về tính chất vật lý như khối lượng.
- Ứng dụng: Đồng vị \( ^{35}\text{Cl} \) và \( ^{37}\text{Cl} \) được sử dụng trong các nghiên cứu về môi trường, hóa học biển, và phân tích các quá trình hóa học.
Việc hiểu rõ về các đồng vị của clo không chỉ giúp chúng ta có cái nhìn sâu hơn về cấu trúc nguyên tử mà còn mở ra những ứng dụng mới trong khoa học và công nghệ.

8. Tổng Kết
Qua những tìm hiểu về nguyên tử số của Clo, chúng ta đã hiểu rõ hơn về vai trò và tính chất của nguyên tố này trong hóa học và đời sống. Clo với số hiệu nguyên tử là 17, thuộc nhóm halogen, là một nguyên tố rất hoạt động và có nhiều ứng dụng thực tiễn.
- Cấu hình electron của Clo là \[3s^{2}3p^{5}\], cho thấy Clo có 7 electron ở lớp vỏ ngoài cùng.
- Clo thường tham gia vào các phản ứng hóa học để đạt được cấu hình bền vững, thông qua việc nhận thêm 1 electron.
- Các đồng vị của Clo, đặc biệt là Cl-35 và Cl-37, đóng vai trò quan trọng trong các phản ứng hóa học và ứng dụng công nghiệp.
- Clo được sử dụng rộng rãi trong công nghiệp, từ xử lý nước, sản xuất chất tẩy rửa, đến khử trùng các dụng cụ y tế và trong sản xuất giấy.
Nhờ những tính chất đặc biệt, Clo không chỉ là một nguyên tố quan trọng trong bảng tuần hoàn mà còn góp phần đáng kể vào các quá trình công nghiệp và y tế, làm cho cuộc sống con người trở nên an toàn và tiện lợi hơn.