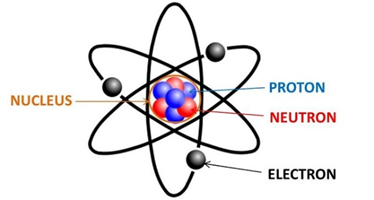
Chủ đề số hiệu nguyên tử cho biết gì: Nguyên tố A có số hiệu nguyên tử là 11, chính là Natri, một kim loại kiềm quan trọng trong bảng tuần hoàn. Bài viết này sẽ giới thiệu chi tiết về cấu tạo, tính chất hóa học, ứng dụng của Natri trong đời sống và công nghiệp, giúp bạn hiểu rõ hơn về nguyên tố quan trọng này.
Mục lục
- Nguyên tố A có số hiệu nguyên tử là 11
- 1. Giới thiệu về nguyên tố A với số hiệu nguyên tử 11
- 2. Cấu tạo nguyên tử của nguyên tố A
- 3. Tính chất hóa học của nguyên tố A
- 4. Tính chất vật lý của nguyên tố A
- 5. Ứng dụng của nguyên tố A trong đời sống và công nghiệp
- 6. So sánh tính chất của nguyên tố A với các nguyên tố lân cận
- 7. Vai trò của nguyên tố A trong tự nhiên và cơ thể con người
- 8. Phương pháp điều chế và tinh chế nguyên tố A
- 9. Cảnh báo an toàn khi làm việc với nguyên tố A
Nguyên tố A có số hiệu nguyên tử là 11
Nguyên tố A có số hiệu nguyên tử là 11 chính là nguyên tố Natri (Na), thuộc nhóm I trong bảng tuần hoàn các nguyên tố hóa học, nằm ở chu kỳ 3.
1. Cấu tạo nguyên tử của Natri
- Nguyên tử Na có số hiệu nguyên tử là 11, tức là có 11 proton trong hạt nhân và 11 electron quay quanh hạt nhân.
- Cấu hình electron của Na là:
\(1s^2 2s^2 2p^6 3s^1\) . - Natri có một electron độc thân ở lớp ngoài cùng (lớp 3s).
2. Tính chất hóa học của Natri
Natri là kim loại mềm, màu trắng bạc, dễ bị oxy hóa khi tiếp xúc với không khí. Dưới đây là một số tính chất hóa học chính của natri:
- Tác dụng với nước: Natri phản ứng mãnh liệt với nước để tạo ra natri hydroxide và khí hydro:
\[2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow\] - Tác dụng với oxi: Khi cháy trong không khí, natri tạo ra natri oxit:
\[4Na + O_2 \rightarrow 2Na_2O\] - Tác dụng với axit: Natri tác dụng với axit clohidric để tạo ra natri clorua và giải phóng khí hydro:
\[2Na + 2HCl \rightarrow 2NaCl + H_2 \uparrow\]
3. Ứng dụng của Natri trong đời sống
- Trong công nghiệp: Natri được sử dụng trong sản xuất đèn hơi natri, một loại đèn có hiệu suất chiếu sáng cao.
- Trong hóa học: Natri là chất khử mạnh, được dùng để chiết xuất một số kim loại từ hợp chất của chúng.
- Trong y tế: Các hợp chất của natri như natri clorua (muối ăn) là thành phần thiết yếu trong chế độ ăn uống hàng ngày.
4. So sánh tính chất hóa học của Natri với các nguyên tố lân cận
- So với Magie (Mg): Natri có tính khử mạnh hơn và dễ dàng tham gia phản ứng hóa học hơn Magie.
- So với Kali (K): Kali còn có tính khử mạnh hơn cả Natri và phản ứng với nước mãnh liệt hơn Natri.
Natri là một nguyên tố có vai trò quan trọng trong cả khoa học và đời sống, với nhiều ứng dụng đa dạng trong các lĩnh vực khác nhau.

.png)
1. Giới thiệu về nguyên tố A với số hiệu nguyên tử 11
Nguyên tố A có số hiệu nguyên tử là 11 chính là Natri (\(Na\)), một kim loại kiềm mềm, màu trắng bạc, nằm ở nhóm 1 của bảng tuần hoàn. Natri là một trong những nguyên tố phổ biến và quan trọng nhất trong tự nhiên, với sự hiện diện chủ yếu trong các hợp chất như muối ăn (\(NaCl\)) và các khoáng chất khác.
Với đặc tính hóa học dễ phản ứng, Natri thường không tồn tại ở dạng nguyên chất trong tự nhiên mà chủ yếu được tìm thấy dưới dạng hợp chất. Trong công nghiệp, Natri được sử dụng rộng rãi trong sản xuất hóa chất, thủy tinh, và trong nhiều quy trình khác. Natri cũng đóng vai trò quan trọng trong các quá trình sinh học, đặc biệt là trong việc duy trì cân bằng điện giải trong cơ thể con người.
- Vị trí trong bảng tuần hoàn: Nhóm 1, chu kỳ 3
- Ký hiệu hóa học: \(Na\)
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: \[22.99\] u
- Độ âm điện: 0.93 (thang Pauling)
Natri được phát hiện lần đầu tiên vào năm 1807 bởi nhà hóa học người Anh Sir Humphry Davy thông qua phương pháp điện phân. Kể từ đó, Natri đã trở thành một trong những nguyên tố quan trọng nhất trong cả công nghiệp và đời sống hằng ngày.
2. Cấu tạo nguyên tử của nguyên tố A
Nguyên tố A, hay Natri (\(Na\)), có số hiệu nguyên tử là 11, điều này có nghĩa là mỗi nguyên tử Natri chứa 11 proton trong hạt nhân của nó. Ngoài ra, Natri có 11 electron phân bố xung quanh hạt nhân trong các lớp vỏ electron.
Cấu hình electron của Natri được viết dưới dạng \[1s^2 2s^2 2p^6 3s^1\], với các electron được phân bố như sau:
- Lớp thứ nhất (K-shell): 2 electron
- Lớp thứ hai (L-shell): 8 electron
- Lớp thứ ba (M-shell): 1 electron
Hạt nhân của Natri cũng chứa các neutron. Số neutron có thể thay đổi tùy thuộc vào đồng vị của Natri, nhưng đồng vị phổ biến nhất là Natri-23, với 12 neutron.
Cấu trúc nguyên tử của Natri mang đến cho nó các tính chất hóa học đặc biệt, đặc biệt là khả năng dễ mất electron duy nhất ở lớp vỏ ngoài cùng (\(3s^1\)), làm cho Natri rất hoạt động về mặt hóa học, đặc biệt trong các phản ứng với nước và không khí.
| Thành phần | Số lượng |
| Proton | 11 |
| Electron | 11 |
| Neutron (trong đồng vị Natri-23) | 12 |

3. Tính chất hóa học của nguyên tố A
Nguyên tố A, hay Natri (\(Na\)), là một kim loại kiềm có tính chất hóa học rất đặc biệt và nổi bật trong nhóm các nguyên tố kiềm. Dưới đây là một số tính chất hóa học chính của Natri:
- Tính khử mạnh: Natri có khả năng dễ dàng mất một electron ở lớp vỏ ngoài cùng, tạo thành ion \(Na^+\). Điều này làm cho Natri là một chất khử mạnh trong các phản ứng hóa học.
- Phản ứng với nước: Natri phản ứng mạnh mẽ với nước, tạo ra khí hydro (\(H_2\)) và dung dịch natri hydroxit (\(NaOH\)). Phản ứng này rất mãnh liệt và tỏa nhiệt mạnh, thậm chí có thể gây nổ nếu lượng Natri lớn: \[ 2Na + 2H_2O \rightarrow 2NaOH + H_2\uparrow \]
- Phản ứng với oxy: Khi để ngoài không khí, Natri nhanh chóng bị oxy hóa và tạo thành lớp màng oxit bảo vệ bề mặt, chủ yếu là natri oxit (\(Na_2O\)) hoặc natri peroxide (\(Na_2O_2\)): \[ 4Na + O_2 \rightarrow 2Na_2O \] \[ 2Na + O_2 \rightarrow Na_2O_2 \]
- Phản ứng với halogen: Natri phản ứng mạnh với các halogen như clo (\(Cl_2\)), brom (\(Br_2\)), hoặc iot (\(I_2\)) để tạo thành các muối natri halide như natri clorua (\(NaCl\)), natri bromide (\(NaBr\)), hoặc natri iodide (\(NaI\)): \[ 2Na + Cl_2 \rightarrow 2NaCl \]
- Phản ứng với axit: Natri phản ứng với các axit vô cơ mạnh như axit hydrochloric (\(HCl\)), tạo ra khí hydro và muối natri clorua: \[ 2Na + 2HCl \rightarrow 2NaCl + H_2\uparrow \]
Những tính chất hóa học này khiến Natri trở thành một nguyên tố rất quan trọng trong công nghiệp hóa chất, sản xuất năng lượng, và trong nhiều ứng dụng khác. Tính chất hoạt động mạnh của Natri cũng yêu cầu các biện pháp an toàn đặc biệt khi xử lý và bảo quản.

XEM THÊM:
4. Tính chất vật lý của nguyên tố A
Nguyên tố A với số hiệu nguyên tử là 11 được biết đến với một số tính chất vật lý đặc trưng. Dưới đây là những thông tin chi tiết về trạng thái vật lý, màu sắc, cấu trúc tinh thể, nhiệt độ nóng chảy và nhiệt độ sôi của nguyên tố này:
4.1. Trạng thái vật lý
Ở điều kiện tiêu chuẩn, nguyên tố A tồn tại ở trạng thái rắn. Nguyên tố này là một kim loại mềm, có thể dễ dàng cắt bằng dao.
4.2. Màu sắc và cấu trúc tinh thể
Nguyên tố A có màu trắng bạc, nhưng khi tiếp xúc với không khí, nó nhanh chóng bị oxy hóa và có thể xuất hiện một lớp phủ mờ màu xám. Cấu trúc tinh thể của nguyên tố A là lập phương tâm khối (BCC), một dạng cấu trúc tinh thể phổ biến trong các kim loại kiềm.
4.3. Nhiệt độ nóng chảy và nhiệt độ sôi
Nguyên tố A có nhiệt độ nóng chảy là khoảng \[98^\circ C\], và nhiệt độ sôi đạt khoảng \[883^\circ C\]. Điều này cho thấy nó có nhiệt độ nóng chảy và sôi tương đối thấp so với nhiều kim loại khác.

5. Ứng dụng của nguyên tố A trong đời sống và công nghiệp
Nguyên tố A, được biết đến với tên gọi là Natri, là một kim loại kiềm quan trọng và có nhiều ứng dụng trong cả đời sống hàng ngày và công nghiệp. Dưới đây là một số ứng dụng nổi bật của Natri:
- Trong ngành công nghiệp hóa chất: Natri là nguyên liệu quan trọng trong sản xuất xút (NaOH) và các hợp chất natri khác. NaOH được sử dụng rộng rãi trong ngành sản xuất giấy, sản xuất xà phòng, và chế biến thực phẩm.
- Trong sản xuất năng lượng: Natri được sử dụng trong một số loại pin, đặc biệt là pin natri-lưu huỳnh, giúp cung cấp năng lượng cho các hệ thống dự trữ năng lượng quy mô lớn.
- Trong y học: Natri là thành phần quan trọng trong các dung dịch tiêm tĩnh mạch, giúp duy trì cân bằng điện giải trong cơ thể. NaCl (muối ăn) được sử dụng phổ biến trong dung dịch truyền dịch.
- Trong chế biến thực phẩm: Natri bicarbonate (NaHCO3), hay còn gọi là baking soda, là một chất phụ gia thực phẩm quan trọng, được sử dụng trong làm bánh và các sản phẩm khác.
- Trong công nghiệp kim loại: Natri được dùng làm chất khử trong quá trình tinh luyện kim loại, giúp loại bỏ tạp chất và cải thiện chất lượng sản phẩm cuối.
Nhờ vào những tính chất hóa học đặc trưng của mình, Natri đóng vai trò không thể thiếu trong nhiều lĩnh vực khác nhau, từ công nghiệp, y học đến đời sống hàng ngày.
6. So sánh tính chất của nguyên tố A với các nguyên tố lân cận
Nguyên tố A có số hiệu nguyên tử là 11, thuộc nhóm IA và nằm ở chu kỳ 3 trong bảng tuần hoàn các nguyên tố hóa học. Đây chính là nguyên tố Natri (Na), một kim loại kiềm. Để hiểu rõ hơn về tính chất của Natri, chúng ta cần so sánh với các nguyên tố lân cận như Liti (Li), Magie (Mg), và Kali (K).
- So sánh với Liti (Li):
Cả Natri và Liti đều là kim loại kiềm, tuy nhiên, Natri có bán kính nguyên tử lớn hơn và tính kim loại mạnh hơn so với Liti. Điều này là do số lớp electron của Natri nhiều hơn Liti (3 lớp so với 2 lớp). Hơn nữa, Natri dễ dàng nhường electron để tạo thành ion Na+ trong các phản ứng hóa học, khiến nó hoạt động mạnh hơn so với Liti.
- So sánh với Magie (Mg):
Magie là kim loại thuộc nhóm IIA, nằm ngay sau Natri trong bảng tuần hoàn. Mặc dù có cùng số lớp electron (3 lớp), Magie có độ âm điện lớn hơn Natri và khả năng nhường electron kém hơn, do đó tính kim loại yếu hơn Natri. Trong phản ứng, Magie thường tạo thành ion Mg2+, cần nhường hai electron, trong khi Natri chỉ cần nhường một electron để tạo thành ion Na+.
- So sánh với Kali (K):
Kali là nguyên tố thuộc cùng nhóm IA như Natri nhưng nằm ở chu kỳ 4. Kali có bán kính nguyên tử lớn hơn Natri do có thêm một lớp electron. Điều này làm cho Kali có tính kim loại mạnh hơn Natri, nghĩa là Kali dễ dàng nhường electron hơn trong các phản ứng hóa học, tạo thành ion K+. Do đó, hoạt động hóa học của Kali mạnh hơn Natri.
Qua so sánh trên, ta thấy rằng Natri có tính kim loại mạnh hơn Liti và Magie nhưng yếu hơn so với Kali. Tính chất hóa học của Natri thể hiện rõ rệt tính kim loại mạnh với khả năng nhường electron dễ dàng, đặc trưng cho các kim loại kiềm.

7. Vai trò của nguyên tố A trong tự nhiên và cơ thể con người
Nguyên tố A, với số hiệu nguyên tử là 11, đóng vai trò quan trọng trong nhiều quá trình tự nhiên cũng như trong cơ thể con người. Dưới đây là một số vai trò cụ thể của nguyên tố A:
7.1. Vai trò trong tự nhiên
Nguyên tố A có mặt phổ biến trong tự nhiên, đặc biệt là trong các hợp chất muối như NaCl, một thành phần chính của nước biển. Vai trò của nguyên tố A trong tự nhiên bao gồm:
- Tham gia vào quá trình điều hòa áp suất thẩm thấu trong các tế bào thực vật và động vật.
- Đóng vai trò quan trọng trong quá trình quang hợp của thực vật, giúp duy trì sự cân bằng ion trong tế bào.
- Nguyên tố A còn giúp điều chỉnh cân bằng nước và ion trong môi trường sống tự nhiên, đóng góp vào sự ổn định của các hệ sinh thái.
7.2. Vai trò trong cơ thể con người
Trong cơ thể con người, nguyên tố A là một trong những chất cần thiết để duy trì các chức năng sinh lý quan trọng:
- Nguyên tố A tham gia vào việc duy trì cân bằng nước và điện giải trong cơ thể, giúp điều hòa áp suất máu và hỗ trợ chức năng của các tế bào thần kinh và cơ bắp.
- Hỗ trợ quá trình dẫn truyền xung thần kinh, đặc biệt là trong hoạt động của hệ thống thần kinh trung ương, nơi nguyên tố A đảm bảo sự truyền tín hiệu nhanh chóng và hiệu quả.
- Nguyên tố A còn tham gia vào quá trình trao đổi chất và tiêu hóa, hỗ trợ hoạt động của các enzym và quá trình hấp thu dinh dưỡng.
- Một lượng vừa đủ của nguyên tố A là cần thiết để duy trì sức khỏe tim mạch, giảm nguy cơ mắc các bệnh liên quan đến huyết áp và tim mạch.

8. Phương pháp điều chế và tinh chế nguyên tố A
Nguyên tố A, với số hiệu nguyên tử là 11, là một kim loại kiềm, và phương pháp điều chế phổ biến của nguyên tố này là thông qua quá trình điện phân nóng chảy. Cụ thể, các bước thực hiện như sau:
- Bước 1: Chuẩn bị nguyên liệu
Để điều chế nguyên tố A, chúng ta bắt đầu với việc sử dụng muối halogenua của nguyên tố này, thường là muối NaCl (Natri Clorua). Muối này sẽ được làm nóng chảy ở nhiệt độ cao để chuẩn bị cho quá trình điện phân.
- Bước 2: Quá trình điện phân
Muối NaCl nóng chảy sẽ được đưa vào bình điện phân với hai điện cực bằng kim loại trơ. Khi áp dụng dòng điện một chiều, các ion natri (\(Na^+\)) sẽ di chuyển về cực âm (catot), tại đây, chúng sẽ nhận electron để tạo thành nguyên tố A:
\[ Na^+ + e^- \rightarrow Na \]
- Bước 3: Thu hồi nguyên tố A
Sau khi nguyên tố A được tạo thành tại catot, nó sẽ tự động tách ra khỏi bề mặt điện cực và nổi lên trên bề mặt muối nóng chảy, nơi nó có thể được thu hồi dưới dạng kim loại nguyên chất.
Phương pháp này là phương pháp chính để điều chế nguyên tố A với độ tinh khiết cao và thường được sử dụng trong công nghiệp để sản xuất natri kim loại.
9. Cảnh báo an toàn khi làm việc với nguyên tố A
Khi làm việc với nguyên tố A, có số hiệu nguyên tử là 11, điều quan trọng là phải tuân thủ các nguyên tắc an toàn để đảm bảo sức khỏe và ngăn ngừa nguy cơ tai nạn.
- Sử dụng trang thiết bị bảo hộ: Luôn đeo găng tay, kính bảo hộ và áo choàng để tránh tiếp xúc trực tiếp với nguyên tố A. Nếu tiếp xúc trực tiếp, nó có thể gây bỏng do tính phản ứng cao của nó.
- Bảo quản đúng cách: Nguyên tố A cần được bảo quản trong dầu khoáng hoặc chất lỏng không phản ứng để tránh tiếp xúc với không khí, vì nó có thể phản ứng mạnh với nước và oxy trong không khí, gây cháy nổ.
- Làm việc trong môi trường thông thoáng: Thực hiện các thí nghiệm hoặc công việc liên quan đến nguyên tố A trong khu vực có thông gió tốt để giảm thiểu nguy cơ hít phải các khí độc phát sinh từ phản ứng của nguyên tố này với các chất khác.
- Tránh xa nguồn nhiệt: Để nguyên tố A cách xa các nguồn nhiệt hoặc ngọn lửa, vì nó rất dễ cháy khi phản ứng với không khí hoặc nước.
- Xử lý sự cố khẩn cấp: Nếu xảy ra sự cố như cháy hoặc tiếp xúc với da, ngay lập tức rửa bằng nước sạch và gọi cấp cứu. Đối với cháy, sử dụng cát khô hoặc bình chữa cháy chứa hóa chất khô để dập lửa, không dùng nước.
- Huấn luyện nhân viên: Đảm bảo rằng tất cả các nhân viên làm việc với nguyên tố A đều được đào tạo đầy đủ về các biện pháp an toàn và biết cách xử lý khi xảy ra sự cố.
Thực hiện đúng các bước trên sẽ giúp bạn làm việc an toàn với nguyên tố A và giảm thiểu các nguy cơ tiềm ẩn.