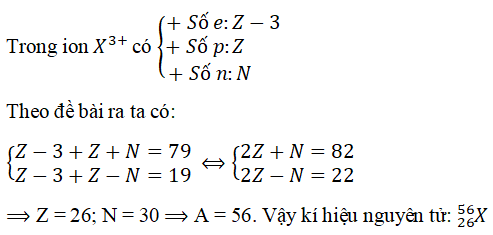Chủ đề nguyên tố x có số hiệu nguyên tử là 14: Nguyên tố X có số hiệu nguyên tử là 14 chính là Silicon, một trong những nguyên tố phổ biến và quan trọng trong cuộc sống. Silicon không chỉ đóng vai trò chủ chốt trong công nghệ bán dẫn mà còn có nhiều ứng dụng thú vị trong các lĩnh vực khoa học và đời sống. Hãy cùng khám phá những đặc điểm nổi bật và tính chất hóa học độc đáo của nguyên tố này!
Mục lục
- Nguyên Tố X Có Số Hiệu Nguyên Tử Là 14
- 1. Giới thiệu về nguyên tố X
- 2. Cấu hình electron của nguyên tố X (Silic)
- 3. Vị trí của nguyên tố Silic trong bảng tuần hoàn
- 4. Ứng dụng của Silic trong đời sống và công nghiệp
- 5. Các hợp chất quan trọng của Silic
- 6. Silic trong tự nhiên và khai thác
- 7. Các bài tập và câu hỏi liên quan đến Silic
- 8. Tổng kết
Nguyên Tố X Có Số Hiệu Nguyên Tử Là 14
Nguyên tố có số hiệu nguyên tử là 14 là Silic (Si). Đây là một phi kim, thuộc nhóm IVA và chu kỳ 3 trong bảng tuần hoàn các nguyên tố hóa học. Silic là một nguyên tố quan trọng, chiếm vị trí thứ hai trong lớp vỏ Trái Đất, chỉ sau oxy.
Tính Chất Hóa Học Của Silic (Si)
- Phản ứng với oxi: Silic tác dụng với oxi ở nhiệt độ cao để tạo ra silic dioxit (SiO₂).
- Phản ứng với axit: Silic không phản ứng với axit loãng như HCl, nhưng tác dụng với axit mạnh hơn như HF để tạo ra khí SiF₄.
- Phản ứng với bazơ: Silic tan trong dung dịch kiềm (NaOH, KOH) tạo ra muối silicat và khí hydro.
Ứng Dụng Của Silic Trong Đời Sống
- Trong công nghiệp điện tử: Silic là chất bán dẫn, được sử dụng rộng rãi trong sản xuất chip máy tính và các thiết bị điện tử khác.
- Trong xây dựng: Silic dioxit (SiO₂) là thành phần chính của cát và đá, được sử dụng để sản xuất bê tông và thủy tinh.
- Trong ngành công nghiệp gốm sứ: Silic được sử dụng làm nguyên liệu trong sản xuất gốm sứ và sơn.
Cấu Trúc Electron Của Silic
Cấu hình electron của Silic là: \[1s^2 2s^2 2p^6 3s^2 3p^2\]. Đây là cấu hình điện tử biểu diễn sự phân bố các electron của Silic trong các lớp vỏ và phân lớp của nguyên tử.
Tính Chất Vật Lý Của Silic
| Điểm nóng chảy | 1414°C |
| Điểm sôi | 2900°C |
| Khối lượng riêng | 2.33 g/cm³ |
| Trạng thái | Rắn ở nhiệt độ phòng |
Tầm Quan Trọng Của Silic Trong Cuộc Sống
Silic đóng vai trò quan trọng trong nhiều lĩnh vực như công nghệ thông tin, xây dựng, và sản xuất các sản phẩm công nghiệp. Với khả năng dẫn nhiệt và điện tốt, Silic là một vật liệu không thể thiếu trong cuộc cách mạng công nghiệp 4.0 hiện nay.
.png)
1. Giới thiệu về nguyên tố X
Nguyên tố X với số hiệu nguyên tử 14 chính là Silicon (Si), một trong những nguyên tố quan trọng và phổ biến nhất trong vỏ trái đất. Silicon chiếm khoảng 27,7% khối lượng của vỏ Trái Đất, đứng thứ hai sau oxy. Đặc biệt, nó được biết đến với vai trò chính trong ngành công nghiệp điện tử và bán dẫn, là thành phần cơ bản để sản xuất các vi mạch và chip xử lý.
- Kí hiệu hóa học: Si
- Số hiệu nguyên tử: 14
- Cấu hình electron: \(1s^2 2s^2 2p^6 3s^2 3p^2\) hoặc viết gọn là [Ne] \(3s^2 3p^2\)
- Vị trí trong bảng tuần hoàn: Nhóm IVA, Chu kỳ 3
- Tính chất hóa học: Là một phi kim, có tính bán dẫn và phản ứng với oxy tạo thành Silicon dioxide (\(SiO_2\)).
Silicon không chỉ nổi tiếng trong ngành công nghệ mà còn là thành phần chủ yếu trong nhiều hợp chất khoáng vật, đặc biệt là các loại đá và cát. Với khả năng tạo liên kết mạnh với oxy, silicon thường xuất hiện dưới dạng silicat và silicon dioxide trong tự nhiên. Trong ngành công nghiệp, silicon được sử dụng để chế tạo kính, xi măng, gốm sứ, và nhiều ứng dụng khác.
Bên cạnh đó, silicon còn đóng vai trò quan trọng trong sự phát triển của công nghệ nano, năng lượng mặt trời, và các vật liệu tiên tiến. Sự linh hoạt và tính chất đặc trưng của silicon khiến nó trở thành một trong những nguyên tố không thể thiếu trong đời sống hiện đại.
2. Cấu hình electron của nguyên tố X (Silic)
Nguyên tố X có số hiệu nguyên tử là 14, đó chính là Silic (Si). Để xác định cấu hình electron của Silic, chúng ta cần phân bố các electron vào các lớp và phân lớp dựa trên số hiệu nguyên tử của nó.
- Bước 1: Xác định số lượng electron của nguyên tử Silic. Với số hiệu nguyên tử 14, Silic có 14 electron.
- Bước 2: Phân bố các electron vào các lớp và phân lớp theo quy tắc của nguyên tắc Hund và nguyên tắc Pauli.
Cấu hình electron của Silic được viết như sau:
- Lớp K (n = 1): chứa tối đa 2 electron.
- Lớp L (n = 2): chứa tối đa 8 electron.
- Lớp M (n = 3): chứa 4 electron còn lại.
Như vậy, cấu hình electron đầy đủ của Silic là:
Để mô tả đơn giản hơn, ta có thể viết gọn cấu hình electron của Silic dưới dạng:
Trong đó, [Ne] đại diện cho cấu hình electron của nguyên tố Neon (1s2 2s2 2p6).
Như vậy, Silic có tổng cộng 14 electron được phân bố trong các lớp và phân lớp theo quy luật của bảng tuần hoàn. Cấu hình electron này cho thấy Silic có 4 electron ở lớp ngoài cùng, điều này giải thích vì sao Silic có tính chất hóa học của một nguyên tố phi kim, nhưng có thể hoạt động như chất bán dẫn trong một số điều kiện nhất định.

3. Vị trí của nguyên tố Silic trong bảng tuần hoàn
Nguyên tố Silic, với ký hiệu hóa học là Si và số hiệu nguyên tử là 14, thuộc nhóm IV và chu kỳ 3 của bảng tuần hoàn các nguyên tố hóa học. Vị trí này xác định một số tính chất quan trọng của Silic, như tính chất bán dẫn, khả năng tạo hợp chất và vai trò quan trọng trong các hợp chất khoáng chất và sinh học.
- Nhóm: IV A (nhóm 14 theo hệ thống hiện đại).
- Chu kỳ: 3.
- Cấu hình electron: \[ 1s^2 2s^2 2p^6 3s^2 3p^2 \].
Silic có 4 electron ở lớp ngoài cùng (lớp vỏ hóa trị), thuộc phân lớp \(3s^2 3p^2\). Đây là các electron quyết định tính chất hóa học của Silic. Với 4 electron này, Silic có khả năng tạo ra 4 liên kết cộng hóa trị, cho phép nó tạo nên các cấu trúc phức tạp trong cả hợp chất hữu cơ và vô cơ.
Silic nằm dưới Carbon (C) trong bảng tuần hoàn, do đó nó có nhiều tính chất tương tự như Carbon, nhưng do có bán kính nguyên tử lớn hơn và lực hút hạt nhân yếu hơn, tính chất hóa học của Silic cũng có một số điểm khác biệt. Silic là một phi kim có độ âm điện thấp hơn Carbon, nhưng vẫn có khả năng tạo liên kết mạnh với các nguyên tố khác, đặc biệt là với Oxy để tạo ra SiO2 (silica), một thành phần quan trọng của thủy tinh, cát, và đá.
Vì vị trí trong bảng tuần hoàn, Silic đóng vai trò quan trọng trong công nghiệp điện tử và viễn thông nhờ tính chất bán dẫn của nó. Khi pha tạp chất với các nguyên tố khác, Silic trở thành nền tảng cho công nghệ sản xuất các vi mạch và bộ vi xử lý.
| Thuộc tính | Giá trị |
|---|---|
| Số hiệu nguyên tử (Z) | 14 |
| Nhóm | IV A (14) |
| Chu kỳ | 3 |
| Cấu hình electron | \[1s^2 2s^2 2p^6 3s^2 3p^2\] |
| Khả năng tạo liên kết | 4 liên kết cộng hóa trị |

4. Ứng dụng của Silic trong đời sống và công nghiệp
Silic (Si) là một nguyên tố quan trọng với nhiều ứng dụng trong đời sống và công nghiệp nhờ tính chất đặc biệt của nó. Từ vật liệu xây dựng đến ngành công nghiệp điện tử, Silic đóng vai trò thiết yếu trong việc tạo ra các sản phẩm công nghệ cao và các vật liệu sử dụng hàng ngày.
- Ngành công nghiệp điện tử: Silic là thành phần chính trong sản xuất chất bán dẫn, vi mạch, và bộ vi xử lý cho máy tính, điện thoại di động và các thiết bị điện tử. Nhờ tính chất bán dẫn, Silic được sử dụng để chế tạo các mạch tích hợp (IC) và transistor.
- Sản xuất thủy tinh và gốm sứ: Silic dioxide (SiO2), một dạng của Silic, là thành phần chính trong thủy tinh và gốm sứ. Cát Silic được dùng để sản xuất kính cửa sổ, gương, và các sản phẩm thủy tinh khác.
- Vật liệu xây dựng: Silic được sử dụng trong sản xuất xi măng, gạch, và bê tông. SiO2 trong dạng cát và đất sét giúp tăng cường độ bền cho các vật liệu xây dựng.
- Sản xuất pin mặt trời: Silic tinh khiết được dùng để chế tạo các tế bào quang điện (pin mặt trời). Nhờ khả năng chuyển đổi ánh sáng mặt trời thành điện năng, Silic đóng vai trò quan trọng trong phát triển năng lượng tái tạo.
- Công nghệ nano: Silic cũng được sử dụng trong các nghiên cứu và ứng dụng công nghệ nano, giúp chế tạo các cảm biến và thiết bị y tế tiên tiến.
Bên cạnh đó, Silic còn xuất hiện trong các sản phẩm tiêu dùng như mỹ phẩm, kem đánh răng, và các loại chất tẩy rửa, nhờ đặc tính an toàn và không gây hại cho sức khỏe con người. Các hợp chất chứa Silic giúp bảo vệ và tăng cường sức khỏe của da và răng, tạo nên sự bền bỉ và độ bóng cho các sản phẩm hàng ngày.
Trong tương lai, các ứng dụng của Silic sẽ tiếp tục mở rộng, đặc biệt trong các ngành công nghiệp xanh và bền vững, giúp giảm thiểu tác động tiêu cực đến môi trường và tăng cường hiệu suất năng lượng.
| Ứng dụng | Vai trò của Silic |
|---|---|
| Ngành công nghiệp điện tử | Chế tạo vi mạch, chất bán dẫn |
| Sản xuất thủy tinh và gốm sứ | Thành phần chính trong thủy tinh, gốm sứ |
| Vật liệu xây dựng | Tăng cường độ bền cho xi măng, gạch, bê tông |
| Sản xuất pin mặt trời | Chế tạo tế bào quang điện |
| Công nghệ nano | Nghiên cứu và chế tạo cảm biến, thiết bị y tế |

5. Các hợp chất quan trọng của Silic
Silic (Si) là một nguyên tố hóa học thuộc nhóm IVA, chu kỳ 3 của bảng tuần hoàn, và là một nguyên tố bán dẫn quan trọng trong ngành công nghiệp điện tử. Các hợp chất của silic đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau, bao gồm:
- Dioxide Silic (\(SiO_2\)):
Dioxide silic hay còn gọi là thạch anh, là một trong những hợp chất phổ biến nhất của silic. Thạch anh tồn tại dưới nhiều dạng như cát, thủy tinh và các loại khoáng chất khác. Hợp chất này được sử dụng rộng rãi trong sản xuất thủy tinh, vật liệu xây dựng, và các sản phẩm gốm sứ.
- Silic Cacbua (\(SiC\)):
Silic cacbua là một hợp chất vô cơ, rất cứng và chịu nhiệt tốt, được dùng trong sản xuất các dụng cụ mài, cắt và trong các ngành công nghiệp đòi hỏi vật liệu chịu mài mòn cao. \(SiC\) cũng được sử dụng trong các thiết bị điện tử, đặc biệt là các thiết bị có khả năng chịu nhiệt độ cao.
- Silic Hydroxit (\(Si(OH)_4\)):
Hợp chất này còn được gọi là axit silicic, có vai trò quan trọng trong các quá trình hóa học và sinh học. Nó có khả năng tạo gel và được sử dụng trong ngành mỹ phẩm, dược phẩm và làm chất keo trong sản xuất sơn, mực in.
- Silicat:
Các hợp chất silicat là thành phần chủ yếu của các khoáng chất trong vỏ trái đất, như mica, fenspat, và amiăng. Silicat được sử dụng trong sản xuất xi măng, gốm sứ, và nhiều loại vật liệu xây dựng khác.
- Polysiloxan:
Hay còn gọi là silicon, là một nhóm hợp chất hữu cơ của silic. Silicon được dùng rộng rãi trong công nghiệp hóa mỹ phẩm, chất bôi trơn, các sản phẩm chăm sóc cá nhân và vật liệu cách điện trong điện tử.
Các hợp chất của silic không chỉ có ý nghĩa trong nghiên cứu khoa học mà còn mang lại nhiều giá trị kinh tế và công nghiệp, đóng góp quan trọng vào đời sống hàng ngày và sự phát triển của xã hội.
XEM THÊM:
6. Silic trong tự nhiên và khai thác
Silic, ký hiệu hóa học là \( \text{Si} \), là nguyên tố phi kim có số hiệu nguyên tử là 14, đứng thứ hai sau oxy về tỷ lệ phổ biến trong lớp vỏ Trái Đất, chiếm khoảng 27,7% khối lượng. Silic không tồn tại ở dạng tự do trong tự nhiên mà thường xuất hiện dưới dạng các hợp chất trong đá, cát, đất sét và khoáng chất như thạch anh, mica, và fenspat.
- Thạch anh (\( \text{SiO}_2 \)): Đây là một trong những dạng phổ biến nhất của silic trong tự nhiên. Thạch anh có nhiều ứng dụng trong công nghiệp, từ sản xuất thủy tinh, gốm sứ đến công nghệ điện tử.
- Đất sét và các khoáng vật silicat: Đất sét chứa nhiều hợp chất của silic, đặc biệt là các silicat. Silicat là nhóm khoáng chất chiếm phần lớn lớp vỏ Trái Đất và là nguồn tài nguyên quý giá cho nhiều ngành công nghiệp như xây dựng, gốm sứ, và hóa chất.
- Cát (\( \text{SiO}_2 \)): Cát chứa thạch anh là nguyên liệu cơ bản cho sản xuất kính và bê tông. Cát thạch anh cũng được sử dụng trong lọc nước và sản xuất vi mạch điện tử.
Quy trình khai thác và sử dụng silic
Quá trình khai thác silic chủ yếu tập trung vào việc chiết tách silic từ các khoáng vật như thạch anh, mica, và các loại cát silic. Sau đây là các bước khai thác và sử dụng silic trong công nghiệp:
- Khai thác: Silic được khai thác từ các mỏ đá thạch anh, cát silic và đất sét. Quá trình khai thác này có thể được thực hiện qua các phương pháp truyền thống như khai thác lộ thiên hoặc khai thác ngầm.
- Chế biến sơ bộ: Sau khi khai thác, silic cần được chế biến sơ bộ để loại bỏ các tạp chất. Các phương pháp như tuyển nổi, lọc, và nghiền được sử dụng để làm sạch và tinh chế quặng silic.
- Sản xuất silic tinh khiết: Silic tinh khiết được sản xuất bằng cách nung chảy quặng thạch anh ở nhiệt độ cao để tách oxy khỏi silic. Phương pháp này thường sử dụng lò điện hồ quang, giúp đạt được silic với độ tinh khiết cao.
- Ứng dụng công nghiệp: Silic tinh khiết được sử dụng rộng rãi trong sản xuất chất bán dẫn cho các thiết bị điện tử như vi mạch, chip máy tính. Ngoài ra, silic cũng được dùng trong sản xuất pin năng lượng mặt trời, hợp kim nhôm-silic và vật liệu xây dựng.
Vai trò của silic trong đời sống và công nghiệp
Silic có vai trò quan trọng trong cả đời sống và công nghiệp. Trong tự nhiên, silic là yếu tố thiết yếu cho nhiều loại thực vật và động vật. Trong công nghiệp, silic đóng vai trò không thể thiếu trong sản xuất vật liệu xây dựng, thiết bị điện tử và năng lượng tái tạo.
| Ứng dụng | Mô tả |
|---|---|
| Sản xuất chất bán dẫn | Silic tinh khiết được sử dụng trong sản xuất vi mạch và chip máy tính. |
| Năng lượng mặt trời | Sử dụng trong các tế bào quang điện của pin mặt trời để chuyển đổi năng lượng ánh sáng thành điện năng. |
| Vật liệu xây dựng | Silic được sử dụng trong sản xuất xi măng, kính và các vật liệu xây dựng khác. |
7. Các bài tập và câu hỏi liên quan đến Silic
Dưới đây là một số bài tập và câu hỏi liên quan đến nguyên tố Silic giúp củng cố kiến thức của bạn về cấu hình electron, vị trí và tính chất hóa học của Silic trong bảng tuần hoàn.
7.1. Bài tập về cấu hình electron của Silic
- Bài 1: Viết cấu hình electron đầy đủ và rút gọn của nguyên tử Silic (Z = 14).
- Đếm số electron của Silic: \(14\) electron.
- Điền electron vào các phân lớp theo thứ tự mức năng lượng từ thấp đến cao: \(1s^2, 2s^2, 2p^6, 3s^2, 3p^2\).
- Cấu hình electron đầy đủ: \(1s^2 2s^2 2p^6 3s^2 3p^2\).
- Cấu hình electron rút gọn: \([Ne] 3s^2 3p^2\).
- Bài 2: Xác định số electron độc thân trong cấu hình electron của Silic và giải thích vai trò của chúng trong tính chất hóa học của Silic.
- Xác định số electron độc thân từ cấu hình electron: Silic có \(3s^2\) và \(3p^2\), trong đó \(p\) có 2 electron độc thân.
- Vai trò: Các electron độc thân này tham gia vào các liên kết cộng hóa trị, xác định khả năng tạo liên kết của Silic với các nguyên tố khác.
Hướng dẫn:
Hướng dẫn:
7.2. Câu hỏi về vị trí và tính chất của Silic trong bảng tuần hoàn
- Câu hỏi 1: Silic nằm ở nhóm nào và chu kỳ nào trong bảng tuần hoàn? Nêu một số tính chất hóa học cơ bản của Silic liên quan đến vị trí của nó.
- Silic nằm ở nhóm IVA và chu kỳ 3 của bảng tuần hoàn.
- Các tính chất hóa học cơ bản bao gồm: tính oxi hóa - khử trung bình, có khả năng tạo hợp chất cộng hóa trị với nhiều nguyên tố.
- Câu hỏi 2: Giải thích tại sao Silic lại có tính bán dẫn và ứng dụng của tính chất này trong công nghiệp điện tử?
- Tính bán dẫn của Silic do cấu trúc electron của nó cho phép tạo ra các lỗ trống và electron tự do khi được kích thích bằng nhiệt hoặc ánh sáng.
- Ứng dụng: Silic là nguyên liệu chính trong sản xuất chip và linh kiện điện tử do khả năng dẫn điện điều chỉnh được.
Hướng dẫn:
Hướng dẫn:
7.3. Các bài tập ứng dụng thực tế
- Bài 3: Silic được sử dụng làm chất xúc tác trong phản ứng hóa học. Hãy viết phương trình phản ứng hóa học mà Silic tham gia với vai trò chất xúc tác.
- Xác định vai trò xúc tác của Silic trong các phản ứng oxi hóa - khử hoặc phản ứng cộng hóa trị.
- Viết phương trình phản ứng tổng quát: \[ A + B \rightarrow C + D \] với sự hiện diện của Silic như một chất xúc tác.
Hướng dẫn:

8. Tổng kết
Nguyên tố Silic (X) với số hiệu nguyên tử là 14, đóng một vai trò quan trọng không chỉ trong hóa học mà còn trong nhiều lĩnh vực khác của đời sống và công nghiệp. Qua các phần đã được trình bày, ta có thể thấy rõ những đặc điểm nổi bật và ứng dụng phong phú của Silic.
8.1. Tóm tắt các điểm chính về nguyên tố Silic
- Silic nằm ở vị trí nhóm 14 và chu kỳ 3 trong bảng tuần hoàn, với cấu hình electron: \(1s^2 2s^2 2p^6 3s^2 3p^2\), cho thấy tính chất hóa học đặc trưng của một phi kim.
- Silic có vai trò quan trọng trong ngành công nghiệp điện tử, đặc biệt trong việc sản xuất chip bán dẫn.
- Các hợp chất của Silic như SiO2 và Silan có ứng dụng rộng rãi trong xây dựng và sản xuất vật liệu.
- Silic tồn tại phổ biến trong tự nhiên dưới dạng khoáng sản như cát và đá, và được khai thác để sử dụng trong nhiều ngành công nghiệp khác nhau.
8.2. Định hướng nghiên cứu thêm về Silic và các nguyên tố liên quan
Trong tương lai, nghiên cứu về Silic cần tập trung vào các ứng dụng mới trong công nghệ cao như năng lượng mặt trời, vật liệu bán dẫn tiên tiến và các hợp chất Silic hữu cơ. Bên cạnh đó, việc khai thác và sử dụng Silic một cách bền vững cũng là một vấn đề cần được quan tâm để bảo vệ tài nguyên thiên nhiên.
Qua đó, việc hiểu rõ về Silic và các ứng dụng của nó không chỉ giúp chúng ta sử dụng nguyên tố này một cách hiệu quả mà còn mở ra nhiều tiềm năng phát triển mới trong khoa học và công nghệ.