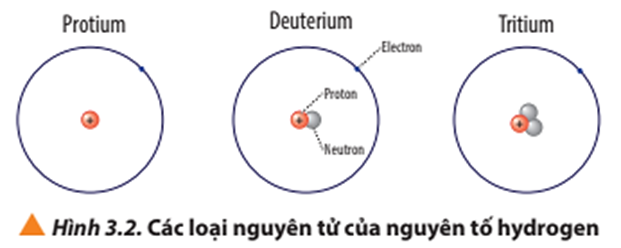
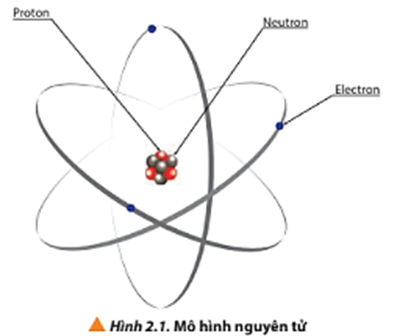
Chủ đề nguyên tử khối 26: Nguyên tử khối 26 thuộc về nguyên tố Sắt (Fe), một kim loại quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Bài viết này sẽ khám phá chi tiết về tính chất, phản ứng hóa học và các ứng dụng thực tiễn của Sắt, giúp bạn hiểu rõ hơn về nguyên tố quan trọng này.
Mục lục
- Nguyên Tử Khối 26 - Sắt (Fe): Tính Chất và Ứng Dụng
- Mục Lục
- 1. Giới Thiệu về Nguyên Tử Khối 26
- 2. Tính Chất Vật Lý và Hóa Học của Sắt (Fe)
- 3. Phản Ứng Hóa Học Quan Trọng của Sắt (Fe)
- 4. Ứng Dụng Của Sắt (Fe) Trong Đời Sống và Công Nghiệp
- 5. Sự Quan Trọng của Sắt (Fe) Đối Với Cơ Thể Người
- 6. Các Hợp Chất Phổ Biến của Sắt (Fe)
- 7. Sắt (Fe) và Những Điều Thú Vị Bạn Chưa Biết
- 1. Giới Thiệu về Nguyên Tử Khối 26 - Sắt (Fe)
- 2. Tính Chất Vật Lý của Sắt (Fe)
- 3. Tính Chất Hóa Học của Sắt (Fe)
- 4. Ứng Dụng của Sắt (Fe) trong Công Nghiệp và Đời Sống
- 5. Vai Trò Của Sắt (Fe) Trong Cơ Thể Người
- 6. Các Hợp Chất Phổ Biến Của Sắt (Fe)
- 7. Những Điều Thú Vị Về Sắt (Fe) và Nguyên Tử Khối 26
Nguyên Tử Khối 26 - Sắt (Fe): Tính Chất và Ứng Dụng
Nguyên tử khối 26 tương ứng với nguyên tố Sắt (Fe) trong bảng tuần hoàn các nguyên tố hóa học. Đây là một kim loại phổ biến với nhiều tính chất hóa học đặc trưng và ứng dụng rộng rãi trong cuộc sống và công nghiệp.
Tính Chất Vật Lý và Hóa Học của Sắt (Fe)
- Số hiệu nguyên tử: 26
- Nguyên tử khối: 55.845 u
- Nhiệt độ nóng chảy: 1540°C
- Khối lượng riêng: 7.87 g/cm³
Phản Ứng Hóa Học của Sắt
Sắt có tính khử trung bình và có thể phản ứng với nhiều nguyên tố khác để tạo thành các hợp chất mới:
- Tác dụng với phi kim: Sắt phản ứng với lưu huỳnh để tạo thành sắt(II) sulfide (\(Fe + S \rightarrow FeS\)) hoặc với oxi để tạo thành sắt(III) oxit (\(4Fe + 3O_2 \rightarrow 2Fe_2O_3\)).
- Phản ứng với axit: Sắt phản ứng với axit clohydric (\(Fe + 2HCl \rightarrow FeCl_2 + H_2\)) và axit sulfuric loãng (\(Fe + H_2SO_4 \rightarrow FeSO_4 + H_2\)) tạo ra muối và khí hydro.
- Phản ứng với dung dịch muối: Sắt có thể thay thế kim loại yếu hơn trong dung dịch muối, ví dụ với đồng(II) sulfat (\(Fe + CuSO_4 \rightarrow FeSO_4 + Cu\)).
- Phản ứng với hơi nước: Khi đun nóng, sắt phản ứng với hơi nước tạo thành sắt(III) oxit và khí hydro (\(3Fe + 4H_2O \rightarrow Fe_3O_4 + 4H_2\)).
Ứng Dụng của Sắt (Fe) trong Cuộc Sống và Công Nghiệp
Sắt là một trong những kim loại được sử dụng rộng rãi nhất trong các ngành công nghiệp và đời sống hàng ngày. Dưới đây là một số ứng dụng tiêu biểu:
- Sản xuất thép: Sắt là thành phần chính trong việc chế tạo thép, được sử dụng để xây dựng cầu, tòa nhà, và đường sắt.
- Chế tạo hợp kim: Sắt được sử dụng để tạo ra các hợp kim như thép không gỉ, cải thiện độ bền và khả năng chống ăn mòn.
- Ứng dụng trong y học: Sắt là một nguyên tố thiết yếu trong cơ thể, tham gia vào quá trình vận chuyển oxy nhờ hemoglobin.
- Ứng dụng khác: Sắt còn được sử dụng trong sản xuất nam châm, linh kiện điện tử và nhiều ngành công nghiệp khác.
Từ những thông tin trên, có thể thấy rằng nguyên tử khối 26 (Sắt) là một nguyên tố vô cùng quan trọng và có nhiều ứng dụng hữu ích trong nhiều lĩnh vực khác nhau của cuộc sống và công nghiệp.

1. Giới Thiệu về Nguyên Tử Khối 26
Tìm hiểu về nguyên tử khối 26 - Sắt (Fe), một trong những nguyên tố quan trọng nhất trong bảng tuần hoàn, có vai trò quyết định trong công nghiệp và đời sống hàng ngày.

2. Tính Chất Vật Lý và Hóa Học của Sắt (Fe)
Khám phá các tính chất vật lý như độ cứng, khối lượng riêng, nhiệt độ nóng chảy của sắt, cùng với những phản ứng hóa học điển hình của nguyên tố này với các chất khác.

XEM THÊM:
3. Phản Ứng Hóa Học Quan Trọng của Sắt (Fe)
3.1. Phản Ứng với Oxy
3.2. Phản Ứng với Axit
3.3. Phản Ứng với Các Phi Kim Khác

4. Ứng Dụng Của Sắt (Fe) Trong Đời Sống và Công Nghiệp
Sắt có vai trò quan trọng trong nhiều lĩnh vực từ xây dựng, sản xuất thép, cho đến các ứng dụng y tế và công nghệ. Đây là nguyên tố không thể thiếu trong nhiều ngành công nghiệp chủ chốt.
5. Sự Quan Trọng của Sắt (Fe) Đối Với Cơ Thể Người
Sắt là thành phần thiết yếu trong máu, giúp vận chuyển oxy trong cơ thể, cũng như đóng vai trò quan trọng trong nhiều quá trình sinh hóa khác.

6. Các Hợp Chất Phổ Biến của Sắt (Fe)
Điểm qua những hợp chất thường gặp của sắt như FeO, Fe₂O₃, và Fe₃O₄, cùng với các ứng dụng và đặc tính của chúng trong công nghiệp và đời sống.

7. Sắt (Fe) và Những Điều Thú Vị Bạn Chưa Biết
Khám phá những thông tin thú vị và ít ai biết về nguyên tố sắt, từ lịch sử phát hiện cho đến những kỷ lục độc đáo liên quan đến sắt.
1. Giới Thiệu về Nguyên Tử Khối 26 - Sắt (Fe)
Nguyên tử khối 26 tương ứng với nguyên tố Sắt (Fe), một kim loại chuyển tiếp có mặt ở vị trí số 26 trong bảng tuần hoàn các nguyên tố hóa học. Sắt là một trong những nguyên tố phong phú nhất trên Trái Đất và chiếm khoảng 5% vỏ Trái Đất. Đây là nguyên tố quan trọng trong ngành công nghiệp, đặc biệt là trong sản xuất thép, nơi sắt được sử dụng để tạo ra các hợp kim có tính chất vượt trội.
Sắt có nguyên tử khối là \[55.845 \, \text{u}\], và có cấu hình electron là \[1s^2 \, 2s^2 \, 2p^6 \, 3s^2 \, 3p^6 \, 3d^6 \, 4s^2\]. Với cấu hình này, sắt thể hiện nhiều trạng thái oxy hóa khác nhau, phổ biến nhất là \[+2\] và \[+3\]. Đây là lý do khiến sắt có nhiều ứng dụng quan trọng trong hóa học và công nghiệp, từ việc tạo ra các hợp chất sắt đa dạng cho đến ứng dụng trong vật liệu xây dựng.
Sắt là nguyên tố không thể thiếu trong cơ thể con người, đặc biệt là trong cấu trúc của hemoglobin, giúp vận chuyển oxy trong máu. Thiếu sắt có thể dẫn đến thiếu máu và nhiều vấn đề sức khỏe khác. Ngoài ra, sắt còn tham gia vào nhiều quá trình sinh học khác, giúp duy trì hoạt động bình thường của các tế bào và cơ quan trong cơ thể.
Nhờ những đặc tính vượt trội và tính ứng dụng cao, sắt là một trong những nguyên tố quan trọng nhất, không chỉ trong lĩnh vực công nghiệp mà còn trong y học và đời sống hàng ngày.

2. Tính Chất Vật Lý của Sắt (Fe)
Sắt (Fe) là một kim loại có nhiều tính chất vật lý đặc trưng, giúp nó trở thành một trong những vật liệu được sử dụng rộng rãi nhất trong nhiều ngành công nghiệp. Dưới đây là một số tính chất vật lý quan trọng của sắt:
- Màu sắc và trạng thái: Sắt là một kim loại màu trắng bạc, có ánh kim, ở điều kiện thường tồn tại ở trạng thái rắn.
- Khối lượng riêng: Sắt có khối lượng riêng là \(\rho = 7.874 \, \text{g/cm}^3\), điều này cho thấy sắt có mật độ tương đối cao.
- Nhiệt độ nóng chảy: Nhiệt độ nóng chảy của sắt là \[1538^\circ \text{C}\], đây là một trong những tính chất quan trọng khiến sắt được sử dụng trong nhiều quá trình luyện kim.
- Điểm sôi: Sắt có điểm sôi ở nhiệt độ rất cao, khoảng \[2862^\circ \text{C}\], điều này cho thấy sắt có thể chịu được nhiệt độ cực cao trước khi chuyển sang trạng thái khí.
- Tính dẫn điện và dẫn nhiệt: Sắt có khả năng dẫn điện và dẫn nhiệt tốt, mặc dù không bằng đồng (Cu) hay bạc (Ag). Tuy nhiên, tính dẫn này đủ để ứng dụng trong nhiều thiết bị điện và điện tử.
- Tính từ: Sắt là một trong những vật liệu từ tính mạnh nhất, đặc biệt trong trạng thái alpha-Fe (dạng ferit). Tính chất từ này được sử dụng trong sản xuất các thiết bị từ như nam châm, lõi biến áp, và các linh kiện điện tử khác.
Những tính chất vật lý trên giúp sắt trở thành một vật liệu quan trọng trong nhiều ngành công nghiệp, từ xây dựng, sản xuất thép, đến chế tạo các thiết bị điện tử. Khả năng chịu nhiệt cao và tính từ mạnh là hai trong số những đặc điểm nổi bật nhất của sắt, làm cho nó không thể thiếu trong cuộc sống hàng ngày.
3. Tính Chất Hóa Học của Sắt (Fe)
Sắt (Fe) là một kim loại có tính chất hóa học đặc trưng của một kim loại chuyển tiếp, với khả năng tham gia vào nhiều phản ứng hóa học khác nhau. Dưới đây là một số tính chất hóa học chính của sắt:
- Tác dụng với phi kim: Sắt dễ dàng phản ứng với oxy trong không khí để tạo thành oxit sắt, phổ biến nhất là \[Fe_2O_3\] (oxit sắt III). Phản ứng này là cơ sở của hiện tượng gỉ sét trên bề mặt sắt khi tiếp xúc với không khí và độ ẩm: \[ 4Fe + 3O_2 \rightarrow 2Fe_2O_3 \]
- Tác dụng với axit: Sắt phản ứng với axit loãng như axit hydrochloric (\(HCl\)) để tạo ra muối sắt II và giải phóng khí hydro (\(H_2\)): \[ Fe + 2HCl \rightarrow FeCl_2 + H_2 \uparrow \]
- Tác dụng với nước: Ở nhiệt độ cao, sắt có thể phản ứng với hơi nước tạo ra oxit sắt từ và khí hydro: \[ 3Fe + 4H_2O \rightarrow Fe_3O_4 + 4H_2 \uparrow \]
- Tác dụng với dung dịch muối: Sắt có thể đẩy kim loại yếu hơn ra khỏi dung dịch muối của chúng. Ví dụ, sắt có thể phản ứng với dung dịch đồng(II) sunfat để tạo ra đồng kim loại và muối sắt(II) sunfat: \[ Fe + CuSO_4 \rightarrow FeSO_4 + Cu \]
Những tính chất hóa học này của sắt làm cho nó trở thành một nguyên tố vô cùng quan trọng trong ngành công nghiệp và hóa học. Sự đa dạng trong phản ứng của sắt không chỉ giúp tạo ra nhiều hợp chất quan trọng mà còn giúp sắt được ứng dụng rộng rãi trong các lĩnh vực khác nhau, từ xây dựng đến y tế.
4. Ứng Dụng của Sắt (Fe) trong Công Nghiệp và Đời Sống
Sắt (Fe) là một trong những kim loại quan trọng và được sử dụng rộng rãi nhất trên thế giới. Các ứng dụng của sắt không chỉ giới hạn trong ngành công nghiệp mà còn lan rộng ra nhiều lĩnh vực trong đời sống hàng ngày. Dưới đây là một số ứng dụng chính của sắt:
- Trong ngành xây dựng: Sắt và thép là những vật liệu chủ chốt trong ngành xây dựng, được sử dụng để tạo ra các công trình như cầu, tòa nhà, đường sắt và các cấu trúc khác. Đặc tính của sắt là độ bền cao và khả năng chịu lực tốt.
- Trong sản xuất máy móc: Sắt được sử dụng rộng rãi trong việc sản xuất các loại máy móc, từ những thiết bị công nghiệp lớn đến các dụng cụ nhỏ hơn trong nhà máy và gia đình. Các bộ phận máy móc như động cơ, máy phát điện, và các bộ phận cơ khí khác đều cần đến sắt hoặc thép.
- Trong ngành giao thông vận tải: Sắt là thành phần chính trong việc chế tạo xe hơi, tàu hỏa, tàu thủy và máy bay. Đặc biệt, thép - hợp kim của sắt - được sử dụng để làm khung xe, vỏ tàu và các cấu trúc chịu lực khác.
- Trong ngành y tế: Sắt là một nguyên tố vi lượng quan trọng trong cơ thể con người, được sử dụng để điều trị thiếu máu và một số bệnh lý khác. Bên cạnh đó, sắt cũng được sử dụng trong sản xuất các thiết bị y tế như dao mổ, kim tiêm và các dụng cụ phẫu thuật khác.
- Trong đời sống hàng ngày: Sắt và thép xuất hiện trong nhiều vật dụng hàng ngày như dao, kéo, đinh, ốc vít, và các dụng cụ nhà bếp. Ngoài ra, sắt cũng là thành phần chính trong nhiều sản phẩm nội thất như giường, bàn, và ghế.
Với sự đa dạng trong ứng dụng và tầm quan trọng trong cả công nghiệp lẫn đời sống, sắt (Fe) đóng vai trò thiết yếu trong việc phát triển kinh tế và cải thiện chất lượng cuộc sống con người.

5. Vai Trò Của Sắt (Fe) Trong Cơ Thể Người
Sắt (\(Fe\)) là một nguyên tố vi lượng không thể thiếu trong cơ thể người, đóng vai trò quan trọng trong nhiều quá trình sinh học. Dưới đây là một số vai trò quan trọng của sắt trong cơ thể:
- 5.1. Thành Phần Của Hemoglobin: Sắt là thành phần chính của hemoglobin, một loại protein trong hồng cầu có nhiệm vụ vận chuyển oxy từ phổi đến các tế bào khắp cơ thể. Mỗi phân tử hemoglobin chứa bốn nguyên tử sắt, giúp liên kết và vận chuyển oxy hiệu quả.
- 5.2. Hỗ Trợ Chức Năng Của Myoglobin: Sắt cũng là thành phần của myoglobin, một protein khác có nhiệm vụ dự trữ và vận chuyển oxy trong cơ bắp. Nhờ có sắt, cơ bắp có thể nhận và dự trữ oxy cần thiết cho các hoạt động thể chất.
- 5.3. Tham Gia Vào Quá Trình Hô Hấp Tế Bào: Sắt tham gia vào quá trình hô hấp tế bào thông qua các enzyme như cytochrome, hỗ trợ chuyển hóa năng lượng từ thực phẩm thành năng lượng cần thiết cho cơ thể.
- 5.4. Tăng Cường Hệ Miễn Dịch: Sắt có vai trò quan trọng trong việc tăng cường chức năng của hệ miễn dịch. Nó giúp cơ thể sản xuất đủ lượng tế bào miễn dịch cần thiết để chống lại các bệnh nhiễm trùng và bệnh tật.
- 5.5. Hỗ Trợ Sự Phát Triển Và Tăng Trưởng: Sắt cần thiết cho sự phát triển và tăng trưởng của trẻ em. Thiếu sắt có thể dẫn đến thiếu máu, làm giảm khả năng tập trung, ảnh hưởng đến sự phát triển thể chất và tinh thần.
- 5.6. Vai Trò Trong Quá Trình Tổng Hợp DNA: Sắt cũng tham gia vào quá trình tổng hợp DNA, là một phần của các enzyme giúp sao chép và sửa chữa DNA trong tế bào, đảm bảo sự phát triển và tái tạo của tế bào.
- 5.7. Duy Trì Sức Khỏe Tâm Thần: Sắt đóng vai trò quan trọng trong việc duy trì sức khỏe tinh thần. Nó giúp sản xuất các chất dẫn truyền thần kinh như dopamine và serotonin, giúp cân bằng tâm trạng và ngăn ngừa các triệu chứng trầm cảm.
Để duy trì sức khỏe tốt, cơ thể cần được cung cấp đủ lượng sắt thông qua chế độ ăn uống hoặc bổ sung khi cần thiết. Một chế độ ăn uống cân bằng, giàu sắt từ các nguồn thực phẩm như thịt đỏ, cá, đậu, và rau xanh sẽ giúp cơ thể phát triển và hoạt động hiệu quả.
6. Các Hợp Chất Phổ Biến Của Sắt (Fe)
Sắt (Fe) là một kim loại quan trọng với nhiều hợp chất phổ biến trong hóa học và công nghiệp. Dưới đây là một số hợp chất nổi bật của sắt và tính chất của chúng.
- Oxide Sắt từ (Fe3O4)
- Tính chất hóa học:
- Là một oxide bazơ, phản ứng với axit tạo muối và nước: \[ Fe_{3}O_{4} + 8HCl \rightarrow 2FeCl_{3} + FeCl_{2} + 4H_{2}O \]
- Là chất khử, có thể bị khử bởi khí hiđro hoặc carbon monoxit: \[ Fe_{3}O_{4} + 4H_{2} \rightarrow 3Fe + 4H_{2}O \]
- Oxide Sắt (III) (Fe2O3)
- Tính chất hóa học:
- Là một oxide bazơ, phản ứng với axit mạnh: \[ Fe_{2}O_{3} + 6HCl \rightarrow 2FeCl_{3} + 3H_{2}O \]
- Có khả năng bị khử ở nhiệt độ cao: \[ Fe_{2}O_{3} + 3CO \rightarrow 2Fe + 3CO_{2} \]
- Sắt (II) hydroxide (Fe(OH)2)
- Tính chất hóa học:
- Có thể tan trong axit mạnh: \[ Fe(OH)_{2} + 2HCl \rightarrow FeCl_{2} + 2H_{2}O \]
- Bị nhiệt phân tạo thành FeO: \[ Fe(OH)_{2} \rightarrow FeO + H_{2}O \]
- Sắt (III) hydroxide (Fe(OH)3)
- Tính chất hóa học:
- Bị nhiệt phân tạo ra Fe2O3: \[ 2Fe(OH)_{3} \rightarrow Fe_{2}O_{3} + 3H_{2}O \]
- Tan trong axit mạnh: \[ Fe(OH)_{3} + 3HCl \rightarrow FeCl_{3} + 3H_{2}O \]
Fe3O4, hay còn gọi là sắt từ, là một oxit hỗn hợp của sắt(II) và sắt(III). Đây là chất rắn màu đen, có từ tính mạnh, và không tan trong nước.
Fe2O3 là một oxit của sắt với màu nâu đỏ, không tan trong nước. Đây là thành phần chính trong quặng hematit.
Fe(OH)2 là chất kết tủa màu trắng xanh, là một bazơ không tan trong nước. Khi bị oxy hóa trong không khí, nó tạo ra Fe(OH)3.
Fe(OH)3 là chất kết tủa màu nâu đỏ, là một bazơ không tan, và có tính chất tương tự như Fe(OH)2.
Các hợp chất của sắt có vai trò quan trọng trong nhiều ngành công nghiệp, đặc biệt là trong sản xuất thép, chất nhuộm và các quy trình hóa học khác.
7. Những Điều Thú Vị Về Sắt (Fe) và Nguyên Tử Khối 26
Sắt, với ký hiệu hóa học là Fe và nguyên tử khối 26, là một trong những nguyên tố phổ biến nhất trên Trái Đất và đã đóng vai trò quan trọng trong sự phát triển của nhân loại.
- Vị trí trong bảng tuần hoàn: Sắt đứng thứ 26, thuộc nhóm 8, chu kỳ 4. Nguyên tố này có cấu hình electron \([Ar] 3d^6 4s^2\) và có khả năng tạo ra nhiều hợp chất đa dạng.
- Đặc điểm vật lý: Sắt là kim loại màu xám bạc, có độ bền cao, dễ uốn và kéo thành sợi. Sắt có khối lượng riêng khoảng \(7.87 \, \text{g/cm}^3\) và nhiệt độ nóng chảy là \(1538 \, ^\circ C\).
- Tính chất hóa học: Sắt dễ bị oxi hóa trong không khí ẩm để tạo thành gỉ sắt, \(Fe_2O_3 \cdot nH_2O\). Sắt còn phản ứng mạnh với axit để tạo ra muối sắt và giải phóng khí hydrogen \(H_2\).
Ứng dụng của sắt: Sắt là một thành phần chính trong sản xuất thép, một hợp kim cực kỳ quan trọng trong xây dựng, chế tạo máy móc và nhiều ngành công nghiệp khác. Ngoài ra, sắt còn là một nguyên tố thiết yếu trong cơ thể con người, tham gia vào quá trình vận chuyển oxy nhờ vào hemoglobin.
Sự hiện diện của sắt trong vũ trụ: Sắt là một trong những nguyên tố nặng được hình thành trong các vụ nổ siêu tân tinh, đóng vai trò quan trọng trong việc cấu thành các hành tinh và ngôi sao. Nguyên tố này cũng là thành phần chính của lõi Trái Đất, góp phần tạo ra từ trường của hành tinh.
Kết luận: Với những tính chất và ứng dụng đa dạng, sắt không chỉ là một nguyên tố hóa học đơn thuần mà còn là nền tảng của nhiều công nghệ hiện đại và sinh học. Những điều thú vị về sắt giúp chúng ta hiểu rõ hơn về tầm quan trọng của nguyên tố này trong cả khoa học và cuộc sống hàng ngày.

.png)