Chủ đề dãy gồm các ion x+ y- và nguyên tử z: Dãy gồm các ion X+, Y- và nguyên tử Z là một chủ đề hấp dẫn trong hóa học, giúp bạn hiểu rõ hơn về cấu hình electron và các tính chất hóa học tương ứng. Bài viết này sẽ mang đến những thông tin sâu sắc về các ứng dụng thực tế và những bài tập vận dụng để bạn dễ dàng nắm vững kiến thức.
Mục lục
- Dãy Gồm Các Ion X+, Y- và Nguyên Tử Z
- Mục Lục Tổng Hợp
- 1. Định Nghĩa Và Tính Chất Của Ion X+, Y- Và Nguyên Tử Z
- 2. Ứng Dụng Thực Tiễn Của Ion X+, Y- Trong Hóa Học
- 3. So Sánh Ion X+, Y- Và Nguyên Tử Z Trong Các Dãy Khác Nhau
- 4. Cách Xác Định Và Phân Tích Các Dãy Ion X+, Y- Trong Bài Tập Hóa Học
- 5. Bài Tập Vận Dụng Ion X+, Y- Và Nguyên Tử Z
- 6. Tổng Kết Và Lợi Ích Của Việc Hiểu Biết Về Dãy Ion X+, Y- Và Nguyên Tử Z
Dãy Gồm Các Ion X+, Y- và Nguyên Tử Z
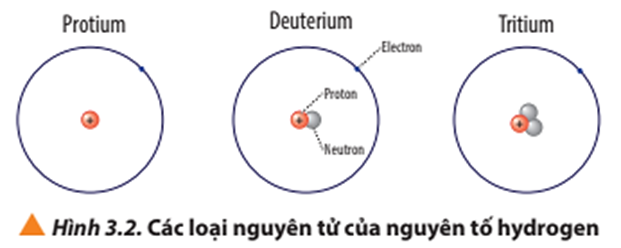
Dãy gồm các ion X+, Y- và nguyên tử Z là một ví dụ điển hình trong cấu hình electron. Các ion và nguyên tử trong dãy này thường có cấu hình electron giống nhau, làm cho chúng có những tính chất hóa học tương đồng.
Cấu Hình Electron
Các ion và nguyên tử trong dãy có cấu hình electron như sau:
- X+: Có thể là Na+ với cấu hình electron \([1s^2 2s^2 2p^6]\).
- Y-: Có thể là F- với cấu hình electron \([1s^2 2s^2 2p^6]\).
- Z: Có thể là nguyên tử Ne với cấu hình electron \([1s^2 2s^2 2p^6]\).
Ví Dụ Các Ion và Nguyên Tử Phổ Biến
Một số ví dụ điển hình về dãy các ion và nguyên tử có cấu hình electron giống nhau:
- Na+, F-, Ne
- Li+, F-, Ne
- K+, Cl-, Ar
Giải Thích Chi Tiết
Các ion X+ và Y- có sự biến đổi số electron khi hình thành từ nguyên tử trung hòa. Ion X+ mất một electron để trở thành ion dương, trong khi ion Y- nhận thêm một electron để trở thành ion âm. Cấu hình electron sau khi biến đổi cho phép các ion này đạt được cấu hình bền vững như của một nguyên tử khí hiếm, chẳng hạn như Ne hoặc Ar.
Ứng Dụng
Các dãy ion và nguyên tử có cấu hình electron giống nhau thường xuất hiện trong các bài toán hóa học, giúp học sinh hiểu rõ hơn về khái niệm cấu hình electron và sự tương đồng về tính chất của các nguyên tố.
| Ion | Cấu Hình Electron | Nguyên Tử Tương Ứng |
|---|---|---|
| Na+ | 1s22s22p6 | Ne |
| F- | 1s22s22p6 | Ne |
| Cl- | 1s22s22p63s23p6 | Ar |
 +, Y- và Nguyên Tử Z" style="object-fit:cover; margin-right: 20px;" width="760px" height="570">
+, Y- và Nguyên Tử Z" style="object-fit:cover; margin-right: 20px;" width="760px" height="570">.png)
Mục Lục Tổng Hợp
Dưới đây là mục lục tổng hợp về chủ đề dãy gồm các ion X+, Y- và nguyên tử Z, giúp bạn khám phá và nắm vững kiến thức một cách toàn diện và chi tiết nhất.
- 1. Định Nghĩa Ion X+, Y- và Nguyên Tử Z
- 1.1 Đặc điểm của Ion X+ và Y-
- 1.2 Cấu trúc và tính chất của nguyên tử Z
- 1.3 Cách thức hình thành ion trong các phản ứng hóa học
- 2. Vai Trò Của Ion X+, Y- Trong Các Phản Ứng Hóa Học
- 2.1 Tác động của ion trong dung dịch
- 2.2 Phản ứng kết tủa và trao đổi ion
- 3. So Sánh Giữa Các Ion Và Nguyên Tử
- 3.1 So sánh tính chất vật lý và hóa học
- 3.2 Mối liên hệ giữa kích thước nguyên tử và ion
- 4. Ứng Dụng Thực Tế Của Ion X+ và Y-
- 4.1 Ứng dụng trong sản xuất hóa chất
- 4.2 Ứng dụng trong công nghệ và đời sống
- 5. Bài Tập Về Dãy Ion X+, Y- và Nguyên Tử Z
- 5.1 Phân tích cấu trúc electron
- 5.2 Giải bài tập ứng dụng và nâng cao
1. Định Nghĩa Và Tính Chất Của Ion X+, Y- Và Nguyên Tử Z
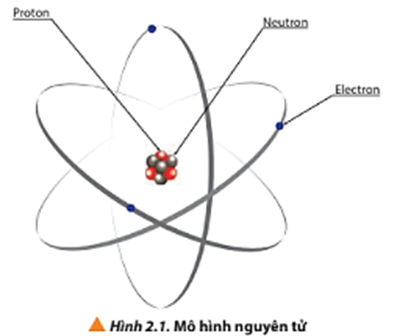
Trong hóa học, dãy gồm các ion X+, Y- và nguyên tử Z là một phần quan trọng để hiểu về cấu trúc và tính chất của các nguyên tố và hợp chất.
- Ion X+
Ion X+ là một cation được tạo thành khi nguyên tử X mất đi một hoặc nhiều electron. Do đó, ion X+ có điện tích dương và nhỏ hơn kích thước nguyên tử X ban đầu.
Công thức tổng quát của ion X+ là \[X^{+}\], và kích thước của nó nhỏ hơn so với nguyên tử X do mất electron ở lớp ngoài cùng.
- Ion Y-
Ngược lại, ion Y- là một anion được hình thành khi nguyên tử Y nhận thêm electron. Điều này làm cho ion Y- có điện tích âm và kích thước lớn hơn nguyên tử Y ban đầu.
Công thức tổng quát của ion Y- là \[Y^{-}\], với kích thước tăng lên do lớp electron bổ sung.
- Nguyên Tử Z
Nguyên tử Z là nguyên tử trung hòa về điện, có số proton bằng với số electron. Kích thước của nguyên tử Z phụ thuộc vào số lượng các lớp electron cũng như sự tương tác giữa các electron và hạt nhân.
Về cấu trúc, nguyên tử Z có công thức tổng quát là \[Z\], không mang điện tích vì tổng số hạt dương và hạt âm cân bằng.
Nhìn chung, ion X+ và Y- khác nhau về kích thước và điện tích so với nguyên tử trung hòa Z, điều này ảnh hưởng lớn đến tính chất hóa học và vật lý của chúng trong các phản ứng hóa học.

2. Ứng Dụng Thực Tiễn Của Ion X+, Y- Trong Hóa Học
Ion X+ và Y- có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau của hóa học, từ công nghiệp cho đến đời sống hàng ngày. Việc hiểu rõ về tính chất và vai trò của chúng giúp tăng cường khả năng ứng dụng trong các phản ứng hóa học và vật liệu.
- Ứng dụng trong điện phân:
Ion X+ và Y- thường được sử dụng trong quá trình điện phân để tách các nguyên tố hoặc hợp chất. Ví dụ, ion X+ có thể được sử dụng để điều chế kim loại từ muối của chúng.
Điện phân là quá trình sử dụng dòng điện để thúc đẩy phản ứng hóa học, trong đó các ion di chuyển và tái tạo thành các nguyên tố nguyên chất hoặc hợp chất mới.
- Vai trò trong tổng hợp hóa chất:
Các ion như X+ và Y- đóng vai trò quan trọng trong các phản ứng tổng hợp hóa học, giúp tạo ra các hợp chất phức tạp từ các nguyên liệu đơn giản hơn.
Điển hình là các ion này có thể tham gia vào phản ứng tạo kết tủa hoặc phản ứng trao đổi ion, giúp điều chỉnh và kiểm soát quá trình tổng hợp.
- Ứng dụng trong sản xuất pin và ắc quy:
Các ion X+ và Y- là thành phần quan trọng trong các quá trình trao đổi điện tích trong pin và ắc quy, giúp cung cấp nguồn năng lượng hóa học ổn định và lâu dài.
Ví dụ, trong pin lithium-ion, các ion Li+ di chuyển giữa các điện cực để tạo ra dòng điện, cung cấp năng lượng cho các thiết bị điện tử.
- Ứng dụng trong xử lý nước:
Các ion Y- thường được sử dụng trong các quá trình xử lý nước, đặc biệt là trong quá trình loại bỏ các ion kim loại nặng độc hại hoặc các chất ô nhiễm.
Quá trình trao đổi ion giúp loại bỏ các ion không mong muốn, cải thiện chất lượng nước, đáp ứng tiêu chuẩn an toàn môi trường.
Nhờ vào tính chất đặc thù của ion X+ và Y-, chúng trở thành những công cụ không thể thiếu trong các lĩnh vực nghiên cứu và ứng dụng thực tiễn của hóa học hiện đại.

XEM THÊM:
3. So Sánh Ion X+, Y- Và Nguyên Tử Z Trong Các Dãy Khác Nhau
Việc so sánh ion X+, Y- và nguyên tử Z trong các dãy khác nhau đóng vai trò quan trọng trong việc hiểu rõ tính chất hóa học của chúng. Dưới đây là một so sánh chi tiết về sự khác biệt giữa các ion và nguyên tử trong các dãy hóa học khác nhau.
| Ion/Nguyên Tử | Tính Chất Hóa Học | Phản Ứng Điển Hình | Ứng Dụng |
|---|---|---|---|
| Ion X+ |
|
Tham gia phản ứng oxi hóa-khử với các chất cho electron, như kim loại. |
Ứng dụng trong công nghiệp điện phân và sản xuất kim loại tinh khiết. |
| Ion Y- |
|
Tham gia phản ứng với ion dương trong quá trình hình thành hợp chất ion. |
Ứng dụng trong xử lý nước, tạo muối và hợp chất ion. |
| Nguyên tử Z |
|
Phản ứng hóa học linh hoạt, có thể bị oxi hóa hoặc khử tùy thuộc vào điều kiện môi trường. |
Được ứng dụng trong nhiều lĩnh vực khác nhau từ công nghiệp đến sinh học. |
Sự khác biệt giữa ion X+, Y- và nguyên tử Z phản ánh tính chất hóa học và khả năng phản ứng của chúng trong các dãy khác nhau. Các ion thường có xu hướng tham gia vào phản ứng oxi hóa-khử mạnh mẽ, trong khi nguyên tử trung hòa có thể linh hoạt hơn trong các loại phản ứng khác nhau.

4. Cách Xác Định Và Phân Tích Các Dãy Ion X+, Y- Trong Bài Tập Hóa Học
Việc xác định và phân tích các dãy ion X+, Y- trong các bài tập hóa học đòi hỏi người học phải nắm rõ cách tính toán và hiểu biết về tính chất của các ion này. Dưới đây là quy trình chi tiết từng bước giúp bạn thực hiện điều này hiệu quả.
- Xác định điện tích của ion:
Điện tích của ion được xác định dựa trên số proton và electron của nguyên tử ban đầu. Ion X+ mất electron để tạo thành điện tích dương, trong khi Y- nhận electron để tạo điện tích âm.
- Tìm kiếm các đặc điểm hóa học của ion:
Để xác định các đặc điểm của ion, ta cần xem xét bán kính ion, năng lượng ion hóa, và ái lực electron. Những tính chất này giúp phân tích sự ổn định và khả năng phản ứng của ion trong dãy.
- Phân tích dãy ion trong bài tập:
Trong bài tập hóa học, dãy ion thường được trình bày dưới dạng các chuỗi phản ứng. Sử dụng các thông tin về điện tích và đặc điểm của ion để tính toán sự chuyển đổi giữa các trạng thái ion khác nhau.
- Áp dụng quy tắc bảo toàn điện tích:
Để xác định chính xác các dãy ion trong bài tập, bạn cần áp dụng quy tắc bảo toàn điện tích, đảm bảo tổng điện tích của hệ thống trước và sau phản ứng bằng nhau.
Qua việc thực hiện các bước trên, bạn sẽ có thể xác định và phân tích chính xác các dãy ion X+, Y- trong bất kỳ bài tập hóa học nào.
5. Bài Tập Vận Dụng Ion X+, Y- Và Nguyên Tử Z
Dưới đây là một số bài tập giúp bạn củng cố kiến thức về các ion X+, Y- và nguyên tử Z. Hãy thực hiện từng bài tập một cách cẩn thận để nắm vững lý thuyết và áp dụng vào thực tiễn.
5.1 Bài Tập Về Tính Chất Hóa Học Của Ion
-
Xác định cấu hình electron của ion X+, Y- và nguyên tử Z trong các trường hợp sau:
- X+ có 11 electron
- Y- có 17 electron
- Nguyên tử Z có 10 electron
Lời giải:
- Cấu hình electron của X+: \[1s^2 2s^2 2p^6\]
- Cấu hình electron của Y-: \[1s^2 2s^2 2p^6 3s^2 3p^6\]
- Cấu hình electron của Z: \[1s^2 2s^2 2p^6\]
-
Viết phương trình hóa học biểu diễn phản ứng giữa ion X+ và Y- tạo thành hợp chất XY.
Lời giải:
- Phương trình phản ứng: \[X^+ + Y^- \rightarrow XY\]
5.2 Bài Tập Xác Định Cấu Hình Electron
-
Cho biết ion X+ thuộc nhóm IA trong bảng tuần hoàn, Y- thuộc nhóm VIIA, và nguyên tử Z thuộc nhóm VIIIA. Hãy xác định cấu hình electron cho từng loại ion và nguyên tử này.
Lời giải:
- X+: \[1s^2 2s^2 2p^6\]
- Y-: \[1s^2 2s^2 2p^6 3s^2 3p^6\]
- Z: \[1s^2 2s^2 2p^6\]
-
Xác định nguyên tố Z biết rằng cấu hình electron của Z là \[1s^2 2s^2 2p^6\].
Lời giải: Z là nguyên tố neon (Ne), thuộc nhóm khí hiếm trong bảng tuần hoàn.
Qua các bài tập trên, bạn đã có thể hiểu rõ hơn về tính chất hóa học, cấu hình electron của các ion X+, Y- và nguyên tử Z, đồng thời biết cách áp dụng kiến thức này vào việc giải quyết các bài tập cụ thể.

6. Tổng Kết Và Lợi Ích Của Việc Hiểu Biết Về Dãy Ion X+, Y- Và Nguyên Tử Z
Hiểu biết về dãy gồm các ion \( X^+ \), \( Y^- \) và nguyên tử \( Z \) mang lại nhiều lợi ích quan trọng, đặc biệt trong lĩnh vực hóa học và vật lý. Dưới đây là một số lợi ích chính mà chúng ta có thể thu được:
- Hiểu rõ cấu hình electron: Việc nắm vững cấu hình electron của các ion và nguyên tử giúp hiểu sâu hơn về tính chất hóa học và vật lý của chúng. Ví dụ, dãy \( \text{Na}^+, \text{Cl}^-, \text{Ar} \) đều có cấu hình electron giống nhau là \( 1s^2 2s^2 2p^6 \), từ đó có thể suy luận về tính chất ổn định và phản ứng của chúng.
- Dự đoán phản ứng hóa học: Kiến thức về cấu hình electron của các ion và nguyên tử cho phép dự đoán cách thức chúng tương tác và phản ứng với nhau. Điều này cực kỳ hữu ích trong việc thiết kế các phản ứng hóa học trong phòng thí nghiệm cũng như trong các ứng dụng công nghiệp.
- Ứng dụng trong công nghiệp: Sự hiểu biết về dãy ion và nguyên tử còn có ứng dụng trong nhiều ngành công nghiệp như chế tạo chất bán dẫn, phát triển vật liệu mới, và nhiều ứng dụng khác trong công nghệ nano.
- Nâng cao kiến thức và tư duy khoa học: Việc tìm hiểu và phân tích các dãy ion và nguyên tử không chỉ giúp mở rộng kiến thức hóa học mà còn phát triển tư duy logic và khoa học, giúp chúng ta có cách nhìn nhận toàn diện hơn về thế giới vật chất.
Tóm lại, việc nắm vững các khái niệm về dãy ion \( X^+ \), \( Y^- \) và nguyên tử \( Z \) không chỉ là nền tảng cho việc học tập và nghiên cứu trong lĩnh vực hóa học, mà còn mở ra nhiều cơ hội ứng dụng trong thực tiễn và công nghiệp. Đây là một trong những bước quan trọng giúp phát triển kiến thức và khả năng tư duy của chúng ta trong thời đại khoa học công nghệ ngày càng phát triển.