Chủ đề quan sát hình 2.5 hãy cho biết nguyên tử: Quan sát hình 2.5 hãy cho biết nguyên tử có cấu tạo như thế nào? Bài viết này sẽ giúp bạn khám phá chi tiết về cấu trúc nguyên tử, từ số lượng proton, neutron đến cách các electron được sắp xếp thành lớp. Đọc ngay để nắm vững kiến thức cơ bản và ứng dụng trong cuộc sống.
Mục lục
- Quan Sát Hình 2.5 và Tìm Hiểu Nguyên Tử
- I. Giới Thiệu Tổng Quan Về Nguyên Tử
- II. Phân Tích Số Lượng Proton, Neutron và Electron
- III. Tính Chất Điện Tích Của Nguyên Tử
- IV. Khối Lượng Nguyên Tử và Đơn Vị Khối Lượng Nguyên Tử (amu)
- V. Các Ví Dụ Cụ Thể Về Nguyên Tử
- VI. Ứng Dụng Của Kiến Thức Nguyên Tử Trong Đời Sống
Quan Sát Hình 2.5 và Tìm Hiểu Nguyên Tử
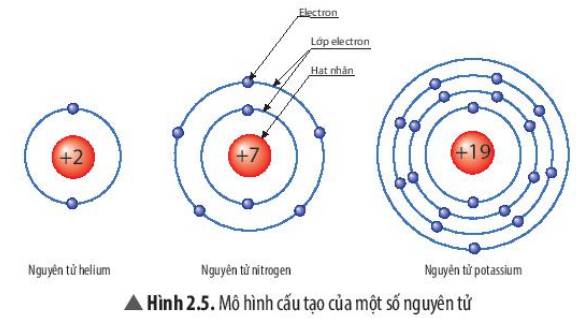
Trong bài học về nguyên tử thuộc chương trình Khoa học Tự nhiên lớp 7, học sinh được yêu cầu quan sát hình 2.5 để hiểu cấu tạo của các nguyên tử. Đây là một phần quan trọng trong việc nắm bắt kiến thức cơ bản về nguyên tử, bao gồm các thành phần như proton, neutron và electron.
1. Nguyên Tử Nitrogen (N)
- Điện tích hạt nhân: \( +7 \)
- Số lớp electron: 2 lớp
- Số electron trên mỗi lớp:
- Lớp thứ nhất: 2 electron
- Lớp thứ hai: 5 electron
2. Nguyên Tử Potassium (K)
- Điện tích hạt nhân: \( +19 \)
- Số lớp electron: 4 lớp
- Lớp thứ hai: 8 electron
- Lớp thứ ba: 8 electron
- Lớp thứ tư: 1 electron
3. Khối Lượng Nguyên Tử
Khối lượng của nguyên tử chủ yếu được xác định bởi khối lượng của hạt nhân, bao gồm các proton và neutron. Điện tích của nguyên tử trung hòa vì số lượng proton và electron bằng nhau, dẫn đến điện tích tổng cộng bằng 0.
4. Các Khái Niệm Quan Trọng
- Hạt nhân nguyên tử: Bao gồm các proton mang điện tích dương và neutron không mang điện.
- Vỏ nguyên tử: Gồm các electron mang điện tích âm, chuyển động xung quanh hạt nhân và sắp xếp thành từng lớp.
- Đơn vị khối lượng nguyên tử (amu): Được sử dụng để biểu thị khối lượng của các hạt trong nguyên tử vì khối lượng của electron quá nhỏ so với proton và neutron.
5. Ví Dụ Tính Toán
| Nguyên Tử | Số Proton | Số Neutron | Số Electron | Khối Lượng (amu) |
|---|---|---|---|---|
| Nhôm (Al) | 13 | 14 | 13 | \[ 13 \times 1 + 14 \times 1 = 27 \text{ amu} \] |
| Đồng (Cu) | 29 | 36 | 29 | \[ 29 \times 1 + 36 \times 1 = 65 \text{ amu} \] |
Kết Luận
Thông qua việc quan sát và phân tích các mô hình nguyên tử, học sinh có thể hiểu rõ hơn về cấu trúc và tính chất của nguyên tử, từ đó có nền tảng vững chắc để học các môn khoa học tự nhiên phức tạp hơn.
.png)
I. Giới Thiệu Tổng Quan Về Nguyên Tử
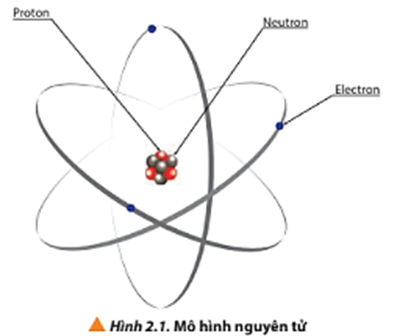
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm hạt nhân nằm ở trung tâm và lớp vỏ điện tử bao quanh. Hạt nhân nguyên tử chứa các proton mang điện tích dương và neutron không mang điện. Số lượng proton trong hạt nhân xác định điện tích hạt nhân và giúp phân biệt các nguyên tử của các nguyên tố khác nhau. Các electron, mang điện tích âm, chuyển động quanh hạt nhân theo quỹ đạo và được sắp xếp thành các lớp hoặc mức năng lượng.
Nguyên tử có tính trung hòa về điện vì số lượng proton trong hạt nhân luôn bằng với số lượng electron xung quanh nó. Trong cấu trúc nguyên tử, các electron được phân bố theo từng lớp, với lớp gần hạt nhân nhất chứa ít electron hơn các lớp phía ngoài. Mỗi lớp electron có số lượng tối đa các electron xác định, ảnh hưởng đến tính chất hóa học của nguyên tử.
- Hạt nhân nguyên tử: chứa proton và neutron.
- Lớp vỏ nguyên tử: chứa các electron di chuyển quanh hạt nhân.
Theo mô hình Rutherford-Bohr, nguyên tử được hình dung như một hệ thống bao gồm hạt nhân ở trung tâm và các electron chuyển động xung quanh theo các quỹ đạo xác định. Các lớp electron này tạo ra sự ổn định cho nguyên tử và quyết định tính chất hóa học của nó. Khi một nguyên tử mất hoặc nhận thêm electron, nó trở thành ion và mang điện tích dương hoặc âm.
II. Phân Tích Số Lượng Proton, Neutron và Electron
Nguyên tử bao gồm ba loại hạt cơ bản: proton, neutron và electron. Mỗi loại hạt này đóng một vai trò quan trọng trong cấu tạo và tính chất của nguyên tử. Proton và neutron tạo thành hạt nhân nguyên tử, trong khi các electron chuyển động quanh hạt nhân theo quỹ đạo xác định. Dưới đây là phân tích chi tiết về số lượng của các hạt này trong một số nguyên tử điển hình.
1. Nguyên Tử Nitrogen (N)
- Số lượng proton: 7
- Số lượng neutron: 7
- Số lượng electron: 7
- Phân bố electron:
- Lớp thứ nhất: 2 electron
- Lớp thứ hai: 5 electron
2. Nguyên Tử Potassium (K)
- Số lượng proton: 19
- Số lượng neutron: 20
- Số lượng electron: 19
- Phân bố electron:
- Lớp thứ nhất: 2 electron
- Lớp thứ hai: 8 electron
- Lớp thứ ba: 8 electron
- Lớp thứ tư: 1 electron
3. Nguyên Tử Đồng (Cu)
- Số lượng proton: 29
- Số lượng neutron: 35
- Số lượng electron: 29
- Phân bố electron:
- Lớp thứ nhất: 2 electron
- Lớp thứ hai: 8 electron
- Lớp thứ ba: 18 electron
- Lớp thứ tư: 1 electron
Tóm lại, mỗi nguyên tử được xác định bởi số lượng proton, neutron và electron. Số lượng proton xác định nguyên tố hóa học, trong khi số lượng neutron có thể thay đổi tạo ra các đồng vị khác nhau. Electron là hạt quyết định tính chất hóa học của nguyên tử, vì chúng tham gia vào các phản ứng hóa học thông qua việc mất, nhận hoặc chia sẻ với các nguyên tử khác.

III. Tính Chất Điện Tích Của Nguyên Tử
Nguyên tử là một hạt vô cùng nhỏ và trung hòa về điện. Điện tích của nguyên tử được tạo thành từ hai thành phần chính là hạt nhân và lớp vỏ electron.
- Hạt nhân nguyên tử chứa các proton mang điện tích dương \((+)\) và neutron không mang điện.
- Lớp vỏ nguyên tử gồm các electron mang điện tích âm \((-)\) chuyển động xung quanh hạt nhân.
Trong trạng thái trung hòa, số proton trong hạt nhân sẽ bằng số electron trong lớp vỏ, từ đó cân bằng điện tích của nguyên tử. Điều này tạo nên tính chất trung hòa về điện của nguyên tử.
Tuy nhiên, nếu nguyên tử mất hoặc nhận thêm electron, nó sẽ trở thành ion mang điện tích dương hoặc âm tùy vào số lượng electron bị mất hoặc nhận.

IV. Khối Lượng Nguyên Tử và Đơn Vị Khối Lượng Nguyên Tử (amu)
Khối lượng của nguyên tử được xác định chủ yếu bởi các hạt proton và neutron trong hạt nhân. Mỗi proton và neutron có khối lượng xấp xỉ 1 đơn vị khối lượng nguyên tử (amu - atomic mass unit).
- Khối lượng của một proton: \[1 \, \text{amu} = 1.6726 \times 10^{-27} \, \text{kg}\]
- Khối lượng của một neutron: \[1 \, \text{amu} = 1.6750 \times 10^{-27} \, \text{kg}\]
- Khối lượng của một electron: nhỏ hơn rất nhiều so với proton và neutron, chỉ khoảng \[9.109 \times 10^{-31} \, \text{kg}\], do đó khối lượng electron thường được bỏ qua khi tính khối lượng nguyên tử.
Khối lượng nguyên tử của một nguyên tố thường được biểu thị dưới dạng số khối, là tổng số proton và neutron trong hạt nhân của nguyên tử. Ví dụ, khối lượng nguyên tử của carbon-12 là 12 amu, trong đó có 6 proton và 6 neutron.
Đơn vị khối lượng nguyên tử (amu) được sử dụng để đơn giản hóa việc tính toán và so sánh khối lượng của các nguyên tử khác nhau, vì khối lượng của một nguyên tử là vô cùng nhỏ so với các đơn vị đo khối lượng thông thường như gam hoặc kilogram.

V. Các Ví Dụ Cụ Thể Về Nguyên Tử
Nguyên tử là đơn vị cơ bản của vật chất, được cấu tạo từ ba loại hạt cơ bản: proton, neutron và electron. Chúng có mặt trong tất cả các nguyên tố hóa học, và sự khác biệt về số lượng các hạt này tạo nên sự đa dạng của các nguyên tố.
Dưới đây là một số ví dụ cụ thể về nguyên tử:
- Nguyên tử Carbon: Carbon có 6 proton, 6 neutron và 6 electron. Nó là nguyên tố cơ bản trong các hợp chất hữu cơ và đóng vai trò quan trọng trong sự sống trên Trái Đất.
- Nguyên tử Oxygen: Oxygen có 8 proton, 8 neutron và 8 electron. Đây là nguyên tố cần thiết cho sự sống, chiếm khoảng 21% khí quyển của Trái Đất.
- Nguyên tử Helium: Helium là một nguyên tố khí nhẹ với 2 proton, 2 neutron và 2 electron. Do tính chất không phản ứng, helium được sử dụng trong các ứng dụng như khí cầu và làm mát.
- Nguyên tử Nitrogen: Nitrogen có 7 proton, 7 neutron và 7 electron. Nó là thành phần chính của không khí và rất quan trọng trong quá trình tổng hợp protein.
Mỗi nguyên tử có cấu tạo và tính chất riêng biệt, tùy thuộc vào số lượng proton, neutron và electron mà chúng chứa. Điều này giúp xác định tính chất vật lý và hóa học của các nguyên tố khác nhau.
XEM THÊM:
VI. Ứng Dụng Của Kiến Thức Nguyên Tử Trong Đời Sống
Nguyên tử, với cấu trúc và tính chất của nó, đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ hiện đại. Việc hiểu rõ về nguyên tử không chỉ giúp chúng ta nắm bắt được bản chất của các vật chất xung quanh mà còn mở ra nhiều ứng dụng thực tiễn trong đời sống.
1. Vai trò của nguyên tử trong hóa học và vật lý
Nguyên tử là đơn vị cơ bản tạo nên mọi vật chất, và việc nghiên cứu cấu trúc nguyên tử đã dẫn đến sự phát triển mạnh mẽ của các ngành khoa học như hóa học và vật lý. Trong hóa học, kiến thức về nguyên tử giúp chúng ta hiểu rõ về phản ứng hóa học, cấu trúc phân tử, và cách các nguyên tố tương tác với nhau. Cụ thể:
- Trong quá trình phân tích hóa học, việc hiểu biết về số lượng và vị trí của các electron trong nguyên tử giúp xác định tính chất hóa học của các nguyên tố.
- Trong vật lý, việc nghiên cứu về nguyên tử đã mở đường cho sự phát triển của vật lý lượng tử, từ đó tạo ra các ứng dụng trong công nghệ viễn thông, điện tử và máy tính.
2. Ứng dụng thực tiễn của nguyên tử trong công nghệ
Kiến thức về nguyên tử không chỉ dừng lại ở lý thuyết mà còn có nhiều ứng dụng thực tiễn, đặc biệt trong công nghệ:
- Công nghệ hạt nhân: Việc hiểu rõ về cấu trúc hạt nhân của nguyên tử đã dẫn đến sự phát triển của công nghệ hạt nhân, từ sản xuất điện hạt nhân đến ứng dụng trong y học như xạ trị ung thư.
- Nanotechnology: Sự hiểu biết về nguyên tử đã mở ra lĩnh vực công nghệ nano, nơi các nhà khoa học có thể thao tác và thiết kế vật liệu ở cấp độ nguyên tử và phân tử, từ đó tạo ra các vật liệu mới với tính năng vượt trội.
- Điện tử và vi mạch: Các tiến bộ trong hiểu biết về nguyên tử đã đóng góp quan trọng vào sự phát triển của công nghệ vi mạch và điện tử, dẫn đến sự ra đời của các thiết bị điện tử ngày càng nhỏ gọn và mạnh mẽ hơn.
Như vậy, kiến thức về nguyên tử không chỉ giúp chúng ta hiểu sâu hơn về thế giới xung quanh mà còn tạo nền tảng cho nhiều tiến bộ công nghệ quan trọng, từ đó cải thiện chất lượng cuộc sống và mở ra những triển vọng mới cho tương lai.