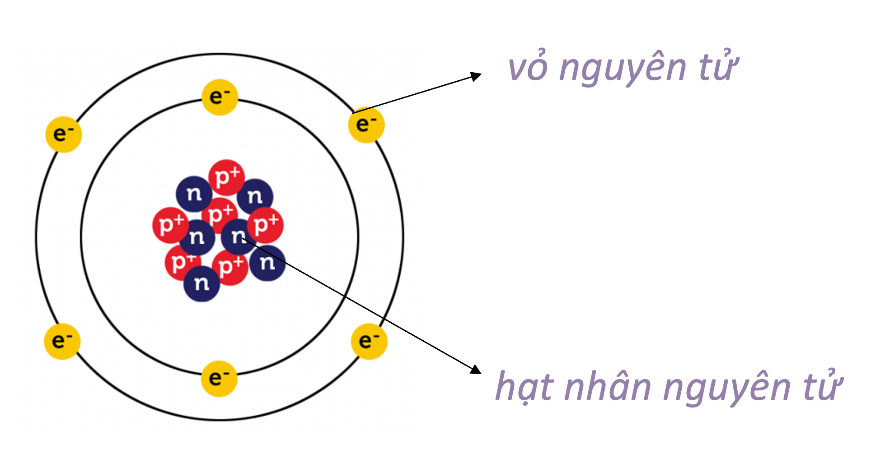
Chủ đề nguyên tử có 4 lớp e là: Nguyên tử có 4 lớp e là một trong những khái niệm cơ bản trong hóa học, giúp hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố. Bài viết này sẽ cung cấp một cái nhìn toàn diện và chi tiết về cấu trúc lớp vỏ electron, cách xác định và ý nghĩa của chúng trong hóa học.
Mục lục
Tìm hiểu về nguyên tử có 4 lớp electron
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm hạt nhân (proton và neutron) và các electron quay xung quanh hạt nhân trong các lớp vỏ. Mỗi nguyên tử có cấu trúc lớp vỏ electron khác nhau, tùy thuộc vào số lượng electron mà nó sở hữu.
Nguyên tử có 4 lớp electron là gì?
Một nguyên tử có 4 lớp electron là nguyên tử mà electron của nó được phân bố vào bốn lớp vỏ năng lượng khác nhau. Các lớp vỏ này được ký hiệu lần lượt là K, L, M, và N.
Ví dụ về cấu hình electron của nguyên tử có 4 lớp:
- Cấu hình electron của Kali (\(K\)): \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^1\]
- Cấu hình electron của Canxi (\(Ca\)): \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\]
Số hiệu nguyên tử và vị trí trong bảng tuần hoàn
Mỗi nguyên tử có số hiệu nguyên tử (Z) đại diện cho số lượng proton trong hạt nhân. Đối với nguyên tử có 4 lớp electron, số hiệu nguyên tử thường rơi vào khoảng từ 19 (Kali) đến 20 (Canxi).
| Nguyên tố | Số hiệu nguyên tử (Z) | Cấu hình electron |
| Kali (K) | 19 | \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^1\] |
| Canxi (Ca) | 20 | \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\] |
Ý nghĩa của lớp electron ngoài cùng
Lớp electron ngoài cùng (lớp vỏ hóa trị) quyết định tính chất hóa học của nguyên tố. Đối với nguyên tử có 4 lớp electron, lớp vỏ ngoài cùng thường chứa 1 hoặc 2 electron, điều này ảnh hưởng đến khả năng phản ứng hóa học của nguyên tố đó.
Ví dụ:
- Kali (K) có 1 electron ở lớp ngoài cùng, dễ dàng nhường electron này để tạo thành ion \(K^+\).
- Canxi (Ca) có 2 electron ở lớp ngoài cùng, dễ dàng nhường 2 electron để tạo thành ion \(Ca^{2+}\).
Tóm tắt
Nguyên tử có 4 lớp electron thường là những nguyên tố thuộc nhóm I và II của bảng tuần hoàn. Chúng có cấu trúc đơn giản và tính chất hóa học dễ dự đoán, thường gặp trong nhiều phản ứng hóa học cơ bản.

.png)
1. Khái niệm về cấu trúc nguyên tử
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm hạt nhân ở trung tâm và các electron quay xung quanh trong các lớp vỏ năng lượng. Cấu trúc nguyên tử xác định các tính chất hóa học của một nguyên tố và được tổ chức thành các lớp vỏ electron theo thứ tự từ gần hạt nhân nhất đến xa nhất.
Mỗi lớp vỏ electron có một mức năng lượng riêng biệt và được xác định bằng các số nguyên từ 1 đến 7, tương ứng với các lớp K, L, M, N, O, P, và Q. Các electron trong lớp vỏ gần hạt nhân hơn có mức năng lượng thấp hơn so với các lớp vỏ ngoài.
Một nguyên tử có 4 lớp electron sẽ có các lớp K, L, M, và N. Số lượng electron trong mỗi lớp vỏ phụ thuộc vào số lượng tổng electron của nguyên tử đó và được sắp xếp theo nguyên tắc Pauli, Hund, và Aufbau.
- Lớp K (lớp 1): Có thể chứa tối đa 2 electron.
- Lớp L (lớp 2): Có thể chứa tối đa 8 electron.
- Lớp M (lớp 3): Có thể chứa tối đa 18 electron.
- Lớp N (lớp 4): Có thể chứa tối đa 32 electron.
Các nguyên tố có 4 lớp electron thường nằm trong các nhóm 1, 2 và nhóm kim loại chuyển tiếp ở bảng tuần hoàn. Cấu trúc này ảnh hưởng mạnh mẽ đến tính chất hóa học của nguyên tố, đặc biệt là khả năng tạo liên kết và phản ứng hóa học.
Ví dụ, cấu hình electron của Kali (\(K\)) là \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^1\], cho thấy nguyên tử này có 4 lớp electron với 1 electron ở lớp vỏ ngoài cùng.
Khái niệm về cấu trúc nguyên tử và sự phân bố electron trong các lớp vỏ là nền tảng quan trọng để hiểu rõ hơn về hóa học và vật lý nguyên tử.
2. Cấu hình electron của nguyên tử
Cấu hình electron của một nguyên tử là sự sắp xếp các electron trong các lớp vỏ năng lượng xung quanh hạt nhân. Cấu hình này quyết định tính chất hóa học của nguyên tử và được xác định theo nguyên tắc Aufbau, Hund, và Pauli.
Một nguyên tử có 4 lớp electron sẽ có cấu hình electron trải qua các lớp K, L, M, và N. Các lớp này tương ứng với các mức năng lượng khác nhau và được điền đầy electron theo thứ tự từ lớp có năng lượng thấp nhất đến cao nhất.
- Lớp K: Lớp này gần hạt nhân nhất và có mức năng lượng thấp nhất, chứa tối đa 2 electron. Cấu hình cho lớp K là \[1s^2\].
- Lớp L: Lớp thứ hai có thể chứa tối đa 8 electron, với cấu hình phổ biến là \[2s^2 2p^6\].
- Lớp M: Lớp thứ ba chứa tối đa 18 electron, với cấu hình có thể là \[3s^2 3p^6 3d^{10}\].
- Lớp N: Lớp thứ tư, chứa tối đa 32 electron, với cấu hình \[4s^2 4p^6 4d^{10} 4f^{14}\], nhưng thông thường sẽ có ít electron hơn tùy vào nguyên tố.
Ví dụ, đối với nguyên tử Canxi (\(Ca\)), cấu hình electron của nó là \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\]. Điều này có nghĩa là Canxi có 4 lớp electron với 2 electron ở lớp ngoài cùng (lớp N).
Cấu hình electron không chỉ giúp xác định vị trí của nguyên tố trong bảng tuần hoàn mà còn cho biết khả năng phản ứng hóa học và tính chất của nguyên tố đó. Các electron ở lớp ngoài cùng (electron hóa trị) là những electron tham gia vào các phản ứng hóa học.
Hiểu rõ cấu hình electron là chìa khóa để nắm bắt các khái niệm quan trọng trong hóa học, từ liên kết hóa học đến sự hình thành của các hợp chất.

3. Vị trí và đặc điểm của các nguyên tố có 4 lớp e
Các nguyên tố có 4 lớp electron thường nằm ở chu kỳ 4 trong bảng tuần hoàn. Những nguyên tố này bao gồm từ Kali (\(K\)) đến Kẽm (\(Zn\)), và một số nguyên tố thuộc nhóm B như đồng (\(Cu\)) và kẽm (\(Zn\)).
Dưới đây là vị trí và một số đặc điểm quan trọng của các nguyên tố này:
- Vị trí: Các nguyên tố có 4 lớp electron nằm trong chu kỳ 4 của bảng tuần hoàn. Điều này có nghĩa là các nguyên tố này có các electron được sắp xếp trong 4 lớp vỏ, với lớp ngoài cùng chứa electron hóa trị.
- Đặc điểm: Các nguyên tố này có tính chất hóa học và vật lý đa dạng:
- Kali (\(K\)): Là kim loại kiềm, rất hoạt động, dễ dàng mất 1 electron để tạo thành ion \(K^+\). Kali có ứng dụng trong nhiều lĩnh vực từ nông nghiệp đến y học.
- Canxi (\(Ca\)): Là kim loại kiềm thổ, rất quan trọng trong sinh học, đặc biệt trong cấu trúc xương và răng. Canxi thường hình thành ion \(Ca^{2+}\).
- Sắt (\(Fe\)): Là kim loại chuyển tiếp, có vai trò quan trọng trong sản xuất thép và các hợp kim. Sắt có các trạng thái oxi hóa phổ biến là \(Fe^{2+}\) và \(Fe^{3+}\).
- Đồng (\(Cu\)): Là kim loại chuyển tiếp, được sử dụng rộng rãi trong các ứng dụng điện và nhiệt. Đồng có tính dẫn điện và dẫn nhiệt cao, thường tồn tại ở trạng thái oxi hóa \(Cu^+\) và \(Cu^{2+}\).
- Kẽm (\(Zn\)): Là kim loại chuyển tiếp, có ứng dụng quan trọng trong mạ điện và hợp kim. Kẽm chủ yếu tồn tại ở trạng thái oxi hóa \(Zn^{2+}\).
Nhìn chung, các nguyên tố có 4 lớp electron có vai trò rất quan trọng trong công nghiệp và sinh học, với nhiều ứng dụng thực tiễn đáng kể trong đời sống hàng ngày.

XEM THÊM:
4. Cách xác định số lớp electron của một nguyên tử
Để xác định số lớp electron của một nguyên tử, chúng ta cần xem xét số hiệu nguyên tử (Z) của nguyên tố đó. Số hiệu nguyên tử tương ứng với số lượng electron trong nguyên tử, và các electron này được sắp xếp theo các lớp vỏ năng lượng khác nhau. Quá trình xác định số lớp electron được thực hiện theo các bước sau:
- Xác định số electron: Dựa vào số hiệu nguyên tử \(Z\), chúng ta biết được số lượng electron trong nguyên tử đó. Ví dụ, nếu \(Z = 20\), thì nguyên tử đó có 20 electron.
- Phân bổ electron vào các lớp: Electron sẽ được sắp xếp từ lớp gần nhân ra ngoài, theo thứ tự tăng dần của mức năng lượng. Các lớp electron được ký hiệu bằng các số nguyên \(n = 1, 2, 3, 4, ...\). Mỗi lớp electron có thể chứa một số lượng tối đa các electron:
- Lớp thứ nhất (\(n = 1\)): Tối đa 2 electron.
- Lớp thứ hai (\(n = 2\)): Tối đa 8 electron.
- Lớp thứ ba (\(n = 3\)): Tối đa 18 electron.
- Lớp thứ tư (\(n = 4\)): Tối đa 32 electron.
- Kiểm tra số lớp electron: Sau khi đã phân bổ hết các electron vào các lớp, số lượng lớp electron tương ứng với số lớp vỏ mà nguyên tử đó có. Ví dụ, nếu nguyên tử có electron nằm ở lớp \(n = 4\), thì nguyên tử đó có 4 lớp electron.
Như vậy, số lớp electron của một nguyên tử được xác định dựa trên việc phân bố các electron theo các mức năng lượng, tuân theo nguyên tắc Pauli và Hund. Đây là một khía cạnh quan trọng trong việc hiểu về cấu trúc và tính chất hóa học của các nguyên tố.

5. Các bài tập thực hành về cấu trúc nguyên tử
Các bài tập thực hành về cấu trúc nguyên tử dưới đây sẽ giúp bạn củng cố kiến thức và nâng cao kỹ năng xác định cấu hình electron, cũng như hiểu rõ hơn về tính chất hóa học của các nguyên tố có 4 lớp electron.
5.1 Bài tập xác định cấu hình electron
Dưới đây là một số bài tập giúp bạn thực hành cách xác định cấu hình electron của các nguyên tử có 4 lớp electron.
- Bài tập 1: Xác định cấu hình electron của nguyên tố Canxi (Ca), biết rằng Canxi có 20 electron.
- Giải: Cấu hình electron của Canxi là:
\[ \text{Ca: } 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 \] - Bài tập 2: Xác định cấu hình electron của nguyên tố Kẽm (Zn), biết rằng Kẽm có 30 electron.
- Giải: Cấu hình electron của Kẽm là:
\[ \text{Zn: } 1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 \] - Bài tập 3: Xác định cấu hình electron của nguyên tố Brom (Br), biết rằng Brom có 35 electron.
- Giải: Cấu hình electron của Brom là:
\[ \text{Br: } 1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^5 \]
5.2 Bài tập về tính chất hóa học
Các bài tập sau đây sẽ giúp bạn hiểu rõ hơn về tính chất hóa học của các nguyên tố có 4 lớp electron và ứng dụng thực tế của chúng.
- Bài tập 1: Nguyên tố Canxi (Ca) phản ứng với nước tạo ra chất gì? Viết phương trình hóa học.
- Giải: Canxi phản ứng với nước tạo ra Canxi hydroxide (Ca(OH)2) và khí hydro (H2):
\[ \text{Ca + 2H}_2\text{O} \rightarrow \text{Ca(OH)}_2 + \text{H}_2 \] - Bài tập 2: Viết phương trình hóa học của phản ứng giữa Kẽm (Zn) và Axit hydrochloric (HCl).
- Giải: Kẽm phản ứng với Axit hydrochloric tạo ra Kẽm chloride (ZnCl2) và khí hydro (H2):
\[ \text{Zn + 2HCl} \rightarrow \text{ZnCl}_2 + \text{H}_2 \] - Bài tập 3: Brom (Br) phản ứng với Natri hydroxide (NaOH) ở điều kiện thường tạo ra những sản phẩm gì?
- Giải: Brom phản ứng với Natri hydroxide tạo ra Natri bromide (NaBr), Natri hypobromite (NaOBr) và nước:
\[ \text{Br}_2 + 2\text{NaOH} \rightarrow \text{NaBr} + \text{NaOBr} + \text{H}_2\text{O} \]