Chủ đề na nguyên tử khối: Na nguyên tử khối là một yếu tố quan trọng trong hóa học, với nhiều ứng dụng thực tế trong đời sống và công nghiệp. Bài viết này sẽ cung cấp chi tiết về nguyên tử khối của natri (Na), phương pháp xác định và các ứng dụng quan trọng của nó. Hãy cùng khám phá và hiểu rõ hơn về một trong những nguyên tố cơ bản này.
Mục lục
Nguyên Tử Khối Của Natri (Na)
Nguyên tử khối của Natri (Na) là một thông số quan trọng trong hóa học, biểu thị khối lượng của một nguyên tử Natri so với đơn vị khối lượng nguyên tử. Khối lượng này được xác định chủ yếu dựa trên số proton và neutron trong hạt nhân của nguyên tử.
Giá Trị Nguyên Tử Khối Của Natri
Nguyên tử khối của Natri được xác định là 22.98976928 \(\text{u}\) (đơn vị khối lượng nguyên tử), tương đương với khoảng 22.98976928 \(\times 1.6605 \times 10^{-27} \text{kg}\). Đây là một giá trị trung bình tính từ các đồng vị của Natri có mặt trong tự nhiên.
Sự Phân Bố Đồng Vị Của Natri
Natri chủ yếu tồn tại dưới dạng đồng vị \(^23\text{Na}\), với số khối (A) là 23, gồm 11 proton và 12 neutron. Một cách tổng quát, số proton (Z) và số neutron (N) của Natri được tính như sau:
- Số proton, \(Z = 11\)
- Số neutron, \(N = A - Z = 23 - 11 = 12\)
Đồng vị này chiếm phần lớn trong tự nhiên, do đó, khối lượng nguyên tử trung bình của Natri gần bằng khối lượng của \(^23\text{Na}\). Các đồng vị khác của Natri tồn tại với tần suất rất thấp và ít có ý nghĩa thực tiễn trong các tính toán hóa học thông thường.
Cách Tính Nguyên Tử Khối Trung Bình
Để tính nguyên tử khối trung bình của một nguyên tố, ta sử dụng công thức:
\[ \text{Nguyên tử khối trung bình} = \frac{\sum (f_i \times A_i)}{\sum f_i} \]
Trong đó:
- \(f_{i}\): phần trăm số nguyên tử của đồng vị thứ i
- \(A_{i}\): khối lượng nguyên tử của đồng vị thứ i
Đối với Natri, do sự chiếm ưu thế của \(^23\text{Na}\), khối lượng nguyên tử trung bình gần như bằng giá trị của đồng vị này.

.png)
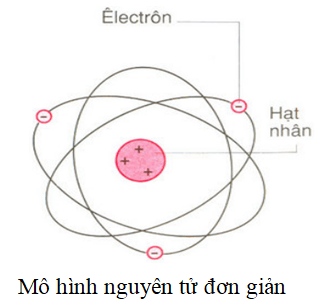
Cấu Trúc Nguyên Tử Của Natri
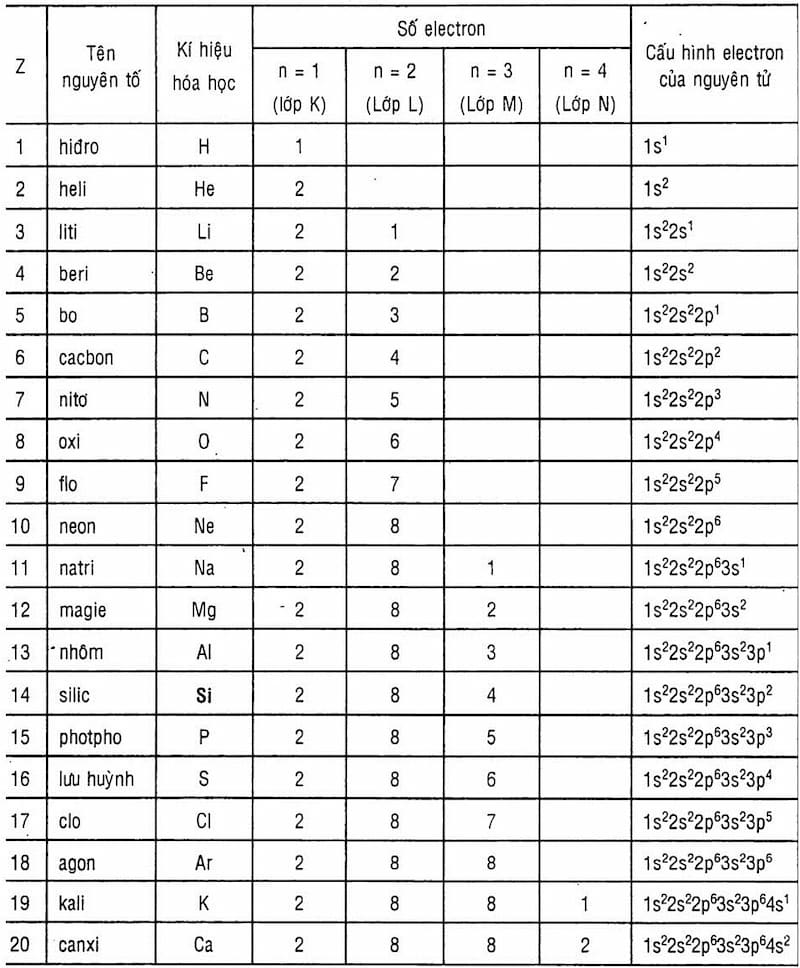
Cấu trúc nguyên tử của Natri gồm có một hạt nhân chứa 11 proton và 12 neutron, bao quanh bởi 11 electron phân bố trên 3 lớp vỏ electron. Sơ đồ phân bố electron của Natri là \(1s^2 2s^2 2p^6 3s^1\).
Phản Ứng Hóa Học Của Natri
Natri là một kim loại hoạt động mạnh, dễ dàng phản ứng với nhiều chất khác nhau. Dưới đây là một số phản ứng tiêu biểu của Natri:
- Phản ứng với nước: \[ 2 \text{Na} + 2 \text{H}_2\text{O} \rightarrow 2 \text{NaOH} + \text{H}_2 \uparrow \]
- Phản ứng với không khí: \[ 4 \text{Na} + \text{O}_2 \rightarrow 2 \text{Na}_2\text{O} \]
- Phản ứng với halogen (ví dụ: chlorine): \[ 2 \text{Na} + \text{Cl}_2 \rightarrow 2 \text{NaCl} \]
Ứng Dụng Của Natri
Trong Đời Sống Hàng Ngày
- Muối ăn (Natri chloride - NaCl): Sử dụng phổ biến trong chế biến thực phẩm và bảo quản thực phẩm. Nó không chỉ là gia vị quan trọng mà còn giúp duy trì cân bằng điện giải trong cơ thể.
- Chất khử mùi và chất tẩy rửa: Natri bicarbonate (NaHCO\(_3\)) thường được sử dụng trong bột nở, chất khử mùi và chất tẩy rửa do khả năng trung hòa axit và mùi hôi.
- Sản phẩm y tế: Natri bicarbonate còn được sử dụng trong y học để điều trị chứng ợ nóng, axit dạ dày và các vấn đề về tiêu hóa khác.
Trong Công Nghiệp
- Sản xuất thủy tinh: Natri carbonate (Na\(_2\)CO\(_3\)) là một thành phần quan trọng trong sản xuất thủy tinh, giúp giảm nhiệt độ nóng chảy của cát silic.
- Công nghiệp hóa chất: Natri hydroxide (NaOH), còn gọi là xút, được sử dụng rộng rãi trong sản xuất giấy, xà phòng, chất tẩy rửa, và trong nhiều quy trình hóa học khác.
- Sản xuất kim loại: Natri được sử dụng trong quá trình sản xuất và tinh chế một số kim loại, chẳng hạn như nhôm, thông qua phương pháp điện phân.
- Điện tử: Natri được sử dụng trong các đèn hơi natri, thường thấy trong chiếu sáng đường phố do hiệu quả phát sáng cao và tuổi thọ dài.
Cấu Trúc Nguyên Tử Của Natri
Cấu trúc nguyên tử của Natri gồm có một hạt nhân chứa 11 proton và 12 neutron, bao quanh bởi 11 electron phân bố trên 3 lớp vỏ electron. Sơ đồ phân bố electron của Natri là \(1s^2 2s^2 2p^6 3s^1\).
Phản Ứng Hóa Học Của Natri
Natri là một kim loại hoạt động mạnh, dễ dàng phản ứng với nhiều chất khác nhau. Dưới đây là một số phản ứng tiêu biểu của Natri:
- Phản ứng với nước: \[ 2 \text{Na} + 2 \text{H}_2\text{O} \rightarrow 2 \text{NaOH} + \text{H}_2 \uparrow \]
- Phản ứng với không khí: \[ 4 \text{Na} + \text{O}_2 \rightarrow 2 \text{Na}_2\text{O} \]
- Phản ứng với halogen (ví dụ: chlorine): \[ 2 \text{Na} + \text{Cl}_2 \rightarrow 2 \text{NaCl} \]
Ứng Dụng Của Natri
Trong Đời Sống Hàng Ngày
- Muối ăn (Natri chloride - NaCl): Sử dụng phổ biến trong chế biến thực phẩm và bảo quản thực phẩm. Nó không chỉ là gia vị quan trọng mà còn giúp duy trì cân bằng điện giải trong cơ thể.
- Chất khử mùi và chất tẩy rửa: Natri bicarbonate (NaHCO\(_3\)) thường được sử dụng trong bột nở, chất khử mùi và chất tẩy rửa do khả năng trung hòa axit và mùi hôi.
- Sản phẩm y tế: Natri bicarbonate còn được sử dụng trong y học để điều trị chứng ợ nóng, axit dạ dày và các vấn đề về tiêu hóa khác.
Trong Công Nghiệp
- Sản xuất thủy tinh: Natri carbonate (Na\(_2\)CO\(_3\)) là một thành phần quan trọng trong sản xuất thủy tinh, giúp giảm nhiệt độ nóng chảy của cát silic.
- Công nghiệp hóa chất: Natri hydroxide (NaOH), còn gọi là xút, được sử dụng rộng rãi trong sản xuất giấy, xà phòng, chất tẩy rửa, và trong nhiều quy trình hóa học khác.
- Sản xuất kim loại: Natri được sử dụng trong quá trình sản xuất và tinh chế một số kim loại, chẳng hạn như nhôm, thông qua phương pháp điện phân.
- Điện tử: Natri được sử dụng trong các đèn hơi natri, thường thấy trong chiếu sáng đường phố do hiệu quả phát sáng cao và tuổi thọ dài.

1. Tổng Quan Về Natri (Na)
Natri (ký hiệu hóa học là Na) là một nguyên tố hóa học thuộc nhóm kim loại kiềm trong bảng tuần hoàn. Nó có số nguyên tử là 11 và khối lượng nguyên tử trung bình là 22.98977 u. Natri là một kim loại mềm, màu trắng bạc, và rất dễ phản ứng với nước và không khí.
1.1. Tính Chất Vật Lý
- Natri có điểm nóng chảy thấp (97.8°C) và điểm sôi cao (883°C).
- Nó là một kim loại mềm, dễ cắt và có mật độ thấp (0.97 g/cm³), nhẹ hơn nước.
- Khi tiếp xúc với không khí, natri nhanh chóng bị oxy hóa và tạo ra một lớp oxit natri màu trắng.
1.2. Tính Chất Hóa Học
- Natri phản ứng mạnh với nước, giải phóng khí hydro và tạo thành dung dịch natri hydroxit (NaOH).
- Nó cũng phản ứng với oxi tạo ra oxit natri (Na₂O) hoặc peroxit natri (Na₂O₂) tùy vào điều kiện phản ứng.
- Natri có khả năng phản ứng với các halogen để tạo ra muối natri halogenua, ví dụ: natri clorua (NaCl).
1.3. Ứng Dụng Thực Tế
Natri và các hợp chất của nó có nhiều ứng dụng trong cuộc sống hàng ngày và công nghiệp:
- Sản xuất hóa chất: Natri được dùng để sản xuất natri peroxit, natri hydroxit và nhiều hóa chất khác.
- Công nghiệp thực phẩm: Natri clorua (muối ăn) là một thành phần quan trọng trong chế biến thực phẩm.
- Công nghệ: Natri được dùng trong đèn hơi natri, pin natri-lưu huỳnh và các loại hợp kim.
1.4. Tầm Quan Trọng Trong Sinh Học
Natri đóng vai trò quan trọng trong cơ thể sinh vật:
- Nó là một ion cần thiết trong việc duy trì áp suất thẩm thấu và cân bằng nước trong cơ thể.
- Natri tham gia vào quá trình truyền tín hiệu thần kinh và co cơ.
- Thiếu hụt natri có thể gây ra các vấn đề sức khỏe như mất cân bằng điện giải, mệt mỏi và chuột rút cơ.
1.5. Các Đồng Vị Của Natri
Natri có nhiều đồng vị, nhưng chỉ có một đồng vị ổn định là 23Na:
| Đồng vị | Nguyên tử khối (u) | Tỉ lệ phần trăm (%) | Chu kỳ bán rã |
|---|---|---|---|
| 23Na | 22.98977 | 100% | Ổn định |
| 22Na | 22.98977 | - | 2.605 năm |
| 24Na | 23.99096 | - | 15 giờ |
1.6. Kết Luận
Natri là một nguyên tố thiết yếu với nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Từ các phản ứng hóa học cơ bản đến vai trò sinh học quan trọng, natri là một phần không thể thiếu trong nghiên cứu và ứng dụng khoa học hiện đại.
2. Tính Chất Vật Lý Của Natri
Natri (Na) là một kim loại kiềm với nhiều tính chất vật lý độc đáo và quan trọng. Dưới đây là một số tính chất vật lý nổi bật của natri:
- Màu sắc và trạng thái: Natri có màu trắng bạc và là kim loại rất mềm, dễ dàng cắt bằng dao.
- Khối lượng riêng: Natri có khối lượng riêng là \(0.968 \, \text{g/cm}^3\).
- Nhiệt độ nóng chảy và sôi: Natri có nhiệt độ nóng chảy là \(97.83^{\circ}C\) và nhiệt độ sôi là \(883^{\circ}C\).
- Độ dẫn điện và dẫn nhiệt: Natri dẫn điện và dẫn nhiệt tốt nhờ cấu trúc mạng tinh thể kim loại của nó.
- Phản ứng với không khí: Natri phản ứng nhanh với không khí tạo thành lớp oxit màu trắng trên bề mặt.
- Phản ứng với nước: Khi tiếp xúc với nước, natri phản ứng mạnh, giải phóng khí hidro và tạo ra natri hidroxit \(NaOH\). Phản ứng này tỏa nhiều nhiệt và có thể gây cháy nổ:
Sơ đồ phản ứng với nước:
Một số tính chất khác:
- Natri dễ dàng hòa tan trong thủy ngân để tạo thành hỗn hống natri.
- Natri không phản ứng với dầu hỏa, do đó thường được bảo quản trong dầu hỏa để tránh phản ứng với không khí và nước.
- Khi đốt cháy trong không khí, natri cho ngọn lửa màu vàng đặc trưng.
Những tính chất vật lý trên giúp natri có nhiều ứng dụng trong công nghiệp và đời sống, từ sản xuất hợp chất hóa học đến ứng dụng trong các thiết bị điện tử.

3. Tính Chất Hóa Học Của Natri
Natri (Na) là một kim loại kiềm với nhiều tính chất hóa học đặc trưng và quan trọng. Dưới đây là một số tính chất hóa học nổi bật của natri:
- Phản ứng với nước: Natri phản ứng mạnh với nước tạo thành natri hidroxit \(NaOH\) và khí hidro \(H_2\). Phản ứng này rất mạnh, tỏa nhiều nhiệt và có thể gây cháy nổ.
Phương trình phản ứng với nước:
- Phản ứng với không khí: Natri phản ứng với oxi trong không khí tạo thành natri oxit \(Na_2O\) hoặc natri peroxit \(Na_2O_2\). Phản ứng này diễn ra nhanh chóng trên bề mặt kim loại tạo ra lớp oxit bảo vệ.
Phương trình phản ứng với oxi:
- Phản ứng với halogen: Natri phản ứng với các halogen như clo, brom, iot để tạo thành muối halogenua tương ứng. Ví dụ, phản ứng với clo tạo thành natri clorua \(NaCl\).
Phương trình phản ứng với clo:
- Phản ứng với axit: Natri phản ứng mạnh với các axit như axit clohidric \(HCl\) để tạo thành muối và giải phóng khí hidro.
Phương trình phản ứng với axit clohidric:
- Phản ứng với hợp chất hữu cơ: Natri có thể phản ứng với một số hợp chất hữu cơ như ancol, amin, để tạo ra các sản phẩm tương ứng. Ví dụ, phản ứng với ancol tạo thành natri ancolat và khí hidro.
Phương trình phản ứng với ancol:
Những tính chất hóa học trên giúp natri có nhiều ứng dụng trong công nghiệp và đời sống, từ sản xuất hợp chất hóa học, làm chất khử trong luyện kim đến ứng dụng trong các phản ứng hữu cơ.
XEM THÊM:
4. Ứng Dụng Của Natri
Natri là một kim loại kiềm có nhiều ứng dụng quan trọng trong cả công nghiệp và đời sống hàng ngày. Nhờ vào tính chất hóa học và vật lý đặc biệt, natri được sử dụng trong nhiều lĩnh vực khác nhau.
-
Sản xuất hợp chất hữu cơ:
Natri là thành phần quan trọng trong sản xuất các hợp chất hữu cơ, đặc biệt là este và các hợp chất hữu cơ khác.
-
Sản xuất xà phòng:
Natri được sử dụng trong các hợp chất với axít béo để sản xuất xà phòng, tạo ra sản phẩm có tính tẩy rửa cao.
-
Đèn hơi natri:
Natri được sử dụng trong đèn hơi natri, một thiết bị cung cấp ánh sáng mạnh và hiệu quả cao, thường được sử dụng trong chiếu sáng đường phố và không gian công cộng.
-
Chất làm mát trong lò phản ứng hạt nhân:
Natri lỏng được sử dụng làm chất làm mát trong một số lò phản ứng hạt nhân do có khả năng dẫn nhiệt tốt và không phản ứng với neutron.
-
Sản xuất kim loại:
Natri kim loại được sử dụng trong việc chiết xuất và tinh chế một số kim loại khác như titan và zirconium, thông qua quá trình khử.
-
Công nghiệp hóa học:
Natri là một chất khử mạnh, được sử dụng trong nhiều phản ứng hóa học công nghiệp để sản xuất các chất như natri peroxit, natri hydroxide (NaOH) và natri carbonate (Na2CO3).
-
Y học:
Hợp chất natri được sử dụng trong y học, chẳng hạn như natri chloride (muối ăn) được sử dụng để duy trì cân bằng điện giải trong cơ thể.
Với những ứng dụng đa dạng và quan trọng, natri đóng vai trò không thể thiếu trong nhiều lĩnh vực khác nhau, từ công nghiệp, y học đến đời sống hàng ngày.

5. Nguyên Tử Khối Của Natri (Na)
Nguyên tử khối của natri, ký hiệu là Na, là một thông số quan trọng trong hóa học. Đây là một kim loại kiềm có nguyên tử khối là 22.98976928 u.
Nguyên tử khối được xác định dựa trên khối lượng của một nguyên tử natri. Nó phản ánh tổng khối lượng của các proton, neutron và electron trong một nguyên tử của nguyên tố này. Để hiểu rõ hơn về nguyên tử khối của natri, chúng ta cần xét đến các yếu tố sau:
- Cấu tạo nguyên tử:
Một nguyên tử natri bao gồm 11 proton, 11 electron và 12 neutron. Tổng khối lượng của các hạt này tạo nên nguyên tử khối của natri.
- Công thức tính:
Nguyên tử khối của một nguyên tố được tính theo công thức:
\[ A = Z \times m_p + (A - Z) \times m_n + Z \times m_e \]Trong đó:
- \( A \) là nguyên tử khối.
- \( Z \) là số proton (11 đối với natri).
- \( m_p \) là khối lượng của proton.
- \( A - Z \) là số neutron (12 đối với natri).
- \( m_n \) là khối lượng của neutron.
- \( m_e \) là khối lượng của electron.
- Tầm quan trọng:
Nguyên tử khối là một thông số quan trọng trong việc tính toán các phản ứng hóa học, đặc biệt là trong việc cân bằng phương trình hóa học và xác định lượng chất tham gia và tạo thành trong phản ứng.
Việc hiểu rõ nguyên tử khối của natri không chỉ giúp chúng ta nắm bắt được các tính chất cơ bản của nguyên tố này mà còn ứng dụng trong nhiều lĩnh vực khác nhau của hóa học và vật lý.

6. Các Phản Ứng Điển Hình Của Natri
Natri (Na) là một kim loại kiềm có tính phản ứng mạnh, đặc biệt khi tiếp xúc với nước, oxi và các chất halogen. Dưới đây là một số phản ứng điển hình của natri, thể hiện tính chất hóa học đặc trưng của nó:
6.1. Phản Ứng Tạo Natri Hydroxit
Khi natri phản ứng với nước, nó tạo ra natri hydroxit (NaOH) và khí hydro (H2) được giải phóng. Phản ứng này rất mãnh liệt, tỏa nhiệt và có thể gây nổ nếu lượng natri lớn:
- Tính chất: Natri hydroxit là một bazơ mạnh, được sử dụng rộng rãi trong công nghiệp hóa chất.
- Ứng dụng: Sản xuất xà phòng, giấy, dược phẩm và các chất tẩy rửa.
6.2. Phản Ứng Tạo Natri Oxit
Natri cũng phản ứng với oxi để tạo thành natri oxit (Na2O). Phản ứng này xảy ra khi đốt cháy natri trong không khí:
- Tính chất: Natri oxit là một oxit bazơ, tan trong nước tạo thành dung dịch kiềm mạnh.
- Ứng dụng: Được sử dụng trong sản xuất thủy tinh và gốm sứ.
6.3. Phản Ứng Tạo Muối Halogenua
Khi natri phản ứng với các halogen như clo (Cl2), brom (Br2), hoặc iot (I2), nó tạo thành các muối halogenua như natri clorua (NaCl), natri bromua (NaBr), và natri iodua (NaI):
- Tính chất: Các muối halogenua của natri là các hợp chất ion, tan trong nước và dẫn điện tốt.
- Ứng dụng: Sử dụng rộng rãi trong chế biến thực phẩm, dược phẩm, và trong công nghiệp hóa chất.