Chủ đề electron of oxygen: Electron của nguyên tố oxy đóng vai trò quan trọng trong nhiều phản ứng hóa học và sự sống trên Trái Đất. Bài viết này cung cấp cái nhìn sâu sắc về cấu hình điện tử của oxy, giải thích cách các electron được phân bố trong các quỹ đạo nguyên tử, và tại sao điều này lại quan trọng trong các phản ứng hóa học, từ quá trình oxi hóa đến sự hình thành liên kết. Hãy cùng khám phá những khía cạnh thú vị của cấu hình electron và tác động của chúng lên thế giới xung quanh chúng ta.
Mục lục
Cấu trúc Electron của Nguyên Tố Oxy
Oxy (ký hiệu hóa học: O) là một nguyên tố thuộc nhóm Chalcogen trong bảng tuần hoàn, với số nguyên tử là 8. Oxy là một khí không màu, không mùi, và rất phản ứng, đóng vai trò là tác nhân oxi hóa mạnh và dễ dàng tạo thành các oxit với hầu hết các nguyên tố khác.
Cấu hình Electron của Nguyên Tử Oxy
Cấu hình electron của nguyên tử oxy có thể được biểu diễn bằng phương pháp đầy đủ như sau:
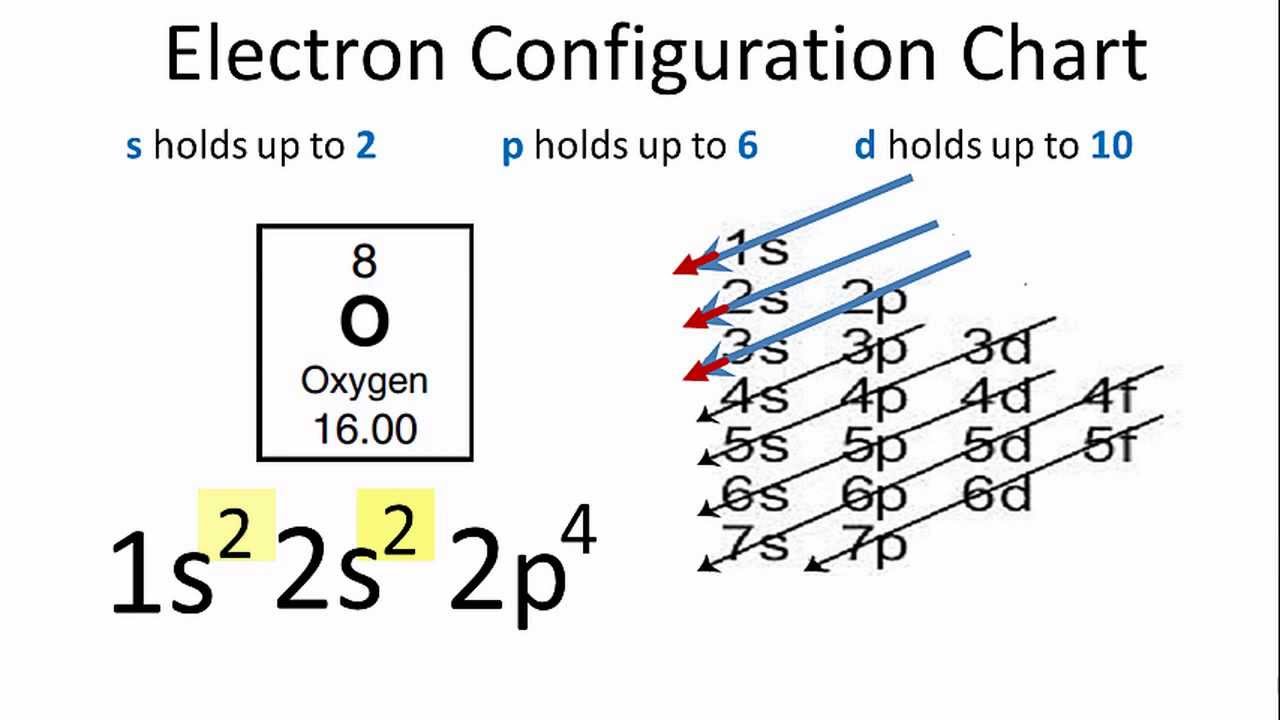
- 1s2 2s2 2p4
Trong đó, 1s2 biểu thị hai electron trong lớp 1s, 2s2 biểu thị hai electron trong lớp 2s, và 2p4 biểu thị bốn electron trong lớp 2p.
Trạng Thái Cơ Bản và Trạng Thái Kích Thích của Electron
Trong trạng thái cơ bản, oxy có cấu hình electron với hai electron không ghép đôi trong các obitan 2p, tạo nên tính chất từ hóa của phân tử oxy (được gọi là trạng thái "triplet oxygen"). Do có các electron không ghép đôi, oxy triplet chỉ phản ứng chậm với hầu hết các phân tử hữu cơ, điều này ngăn chặn sự cháy tự phát.
Oxy còn có thể tồn tại ở dạng oxy singlet, là một trạng thái kích thích năng lượng cao hơn trong đó tất cả các spin electron đều ghép đôi. Oxy singlet rất phản ứng với các phân tử hữu cơ thông thường và được tạo ra trong tự nhiên từ quá trình quang hợp.
Số Electron Hóa Trị và Ứng Dụng Hóa Học
Oxy có sáu electron hóa trị nằm ở lớp vỏ ngoài cùng (2s2 2p4). Các electron này đóng vai trò quan trọng trong việc tạo liên kết hóa học và xác định tính chất hóa học của nguyên tố.
Vì có tính phản ứng cao, oxy được sử dụng rộng rãi trong nhiều quá trình công nghiệp và sinh học. Ví dụ, oxy tham gia vào quá trình hô hấp tế bào của sinh vật và là thành phần chính trong quá trình đốt cháy.
Các Dạng Thù Hình Của Oxy
- Oxy dioxy (O2): Là dạng oxy phổ biến nhất, có liên kết đôi giữa hai nguyên tử oxy.
- Ozone (O3): Một dạng thù hình khác của oxy, có tính chất rất phản ứng và có khả năng gây hại cho mô phổi.
Kết Luận
Oxy là một nguyên tố vô cùng quan trọng trong hóa học và sinh học, đóng vai trò thiết yếu trong các quá trình sống và công nghiệp. Hiểu biết về cấu trúc electron và tính chất hóa học của oxy giúp chúng ta khai thác và ứng dụng nó một cách hiệu quả trong cuộc sống hàng ngày.
.png)
1. Giới thiệu về Oxy
Oxy (ký hiệu hóa học: O) là một nguyên tố phi kim rất phổ biến và quan trọng trong tự nhiên, chiếm khoảng 20% không khí trên Trái Đất. Oxy là một khí không màu, không mùi, có khả năng phản ứng cao và đóng vai trò then chốt trong các quá trình hóa học, bao gồm việc duy trì sự sống thông qua quá trình hô hấp và phản ứng cháy. Trong tự nhiên, oxy tồn tại chủ yếu dưới dạng khí phân tử \(O_2\) và là thành phần chủ yếu trong nhiều hợp chất như nước (\(H_2O\)), oxit kim loại, và các silicat.
Trong bảng tuần hoàn, oxy thuộc nhóm chalcogen và có số nguyên tử là 8. Oxy đóng vai trò như một chất oxi hóa mạnh, có khả năng kết hợp nhanh chóng với hầu hết các nguyên tố khác để tạo thành oxit. Các tính chất hóa học và vật lý của oxy đã giúp cho nguyên tố này trở thành một phần không thể thiếu trong các ngành công nghiệp như y tế, hóa chất, và năng lượng.
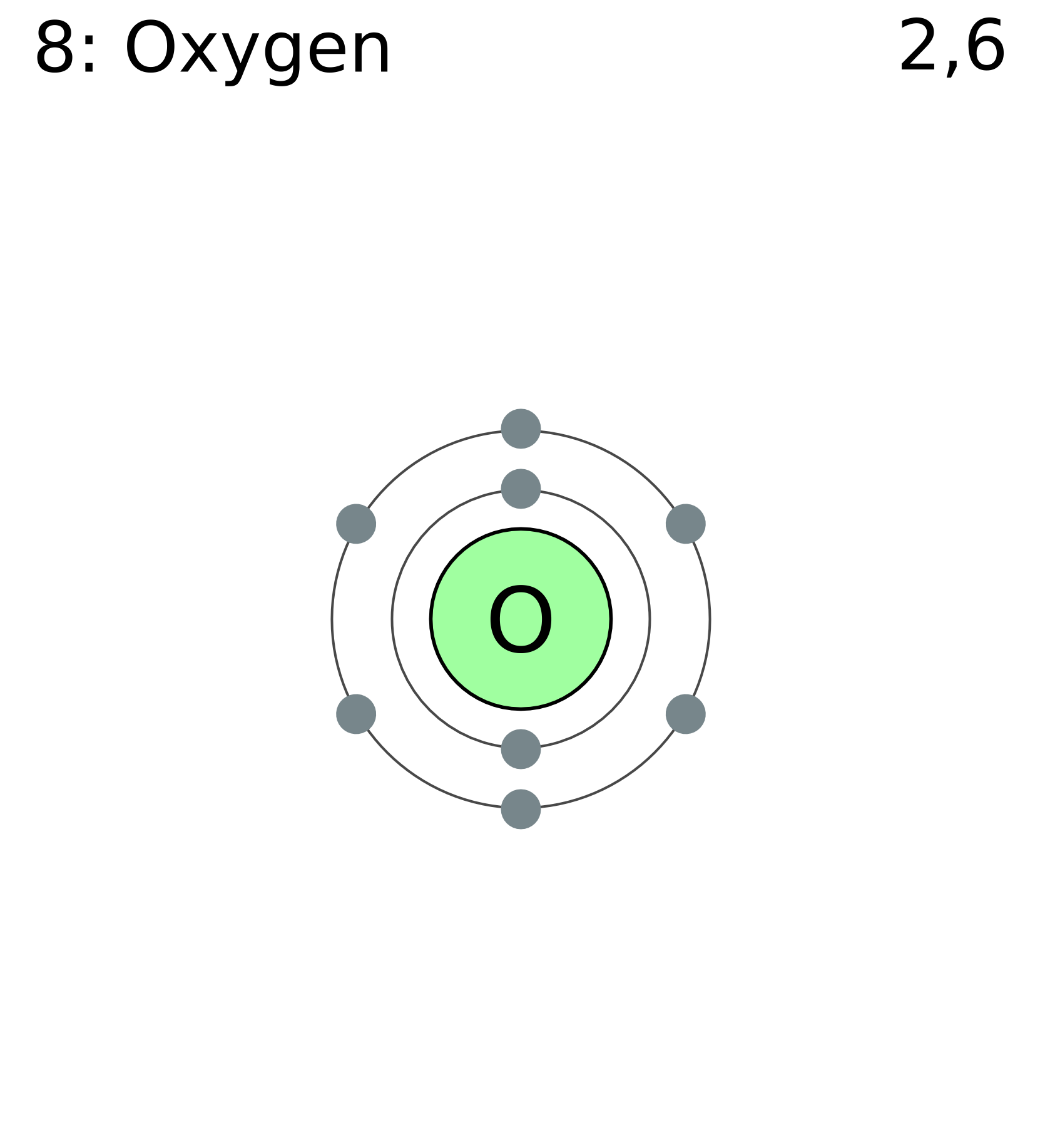
- Oxy có 8 electron được sắp xếp trong các lớp vỏ theo cấu hình: \(1s^2 2s^2 2p^4\). Điều này giúp giải thích cách thức oxy tham gia vào các phản ứng hóa học, đặc biệt là trong quá trình tạo liên kết hóa học.
- Lớp vỏ ngoài cùng của oxy chứa 6 electron, khiến cho nguyên tử này dễ dàng thu nhận thêm 2 electron để hoàn thiện lớp vỏ valence, trở thành ion \(O^{2-}\) có cấu hình bền vững giống như khí hiếm neon (\([He] 2s^2 2p^6\)).
Do vai trò quan trọng của mình, oxy không chỉ là yếu tố cần thiết cho sự sống mà còn là thành phần chính của nhiều hợp chất quan trọng trên Trái Đất.
2. Cấu hình electron của nguyên tử Oxy
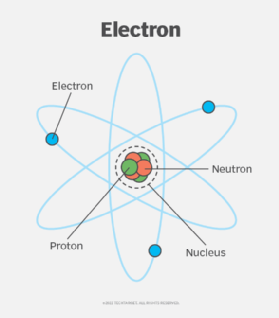
Nguyên tử oxy có số nguyên tử là 8, nghĩa là nó có 8 electron sắp xếp trong các lớp vỏ electron xung quanh hạt nhân. Để xác định cấu hình electron của oxy, ta cần phân bố 8 electron này vào các orbital theo thứ tự mức năng lượng tăng dần, tuân theo quy tắc Aufbau, quy tắc Hund và nguyên lý Pauli.
- Bước 1: Các electron đầu tiên được điền vào orbital có mức năng lượng thấp nhất, đó là orbital \(1s\). Do mỗi orbital chỉ chứa tối đa 2 electron, 2 electron đầu tiên sẽ đi vào orbital \(1s\): \(1s^2\).
- Bước 2: Tiếp theo, 2 electron tiếp theo sẽ đi vào orbital \(2s\), vì đây là orbital có mức năng lượng thấp kế tiếp: \(2s^2\).
- Bước 3: Sau khi các orbital \(1s\) và \(2s\) đã đầy, 4 electron còn lại sẽ được điền vào các orbital \(2p\). Các orbital \(2p\) có 3 phân lớp (px, py, pz) và mỗi phân lớp có thể chứa tối đa 2 electron. Theo quy tắc Hund, các electron sẽ được điền vào từng phân lớp một cách đơn lẻ trước khi ghép cặp. Do đó, ba electron đầu tiên sẽ điền vào ba phân lớp p theo chiều cùng spin, electron thứ tư sẽ ghép cặp với một trong ba electron đã có trong một phân lớp: \(2p^4\).
Vì vậy, cấu hình electron đầy đủ của nguyên tử oxy là:
- Cấu hình electron: \(1s^2 2s^2 2p^4\).
- Viết tắt: \([He] 2s^2 2p^4\), trong đó \([He]\) đại diện cho cấu hình electron của khí hiếm heli.
Cấu hình này cho thấy rằng oxy có 6 electron ở lớp vỏ ngoài cùng, tức là có 6 electron hóa trị. Điều này giải thích vì sao oxy có xu hướng nhận thêm 2 electron để đạt được cấu hình bền vững của khí hiếm (neon), trở thành ion \[O^{2-}\]. Các electron chưa ghép cặp trong các orbital p cũng khiến oxy có tính oxi hóa mạnh, dễ dàng tạo liên kết hóa học với các nguyên tố khác.

3. Tính chất hóa học và vật lý của Oxy
Oxy (O) là nguyên tố phi kim thuộc nhóm 16 trong bảng tuần hoàn, đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học. Dưới đây là các tính chất hóa học và vật lý đặc trưng của oxy:
- Tính chất vật lý:
- Màu sắc và trạng thái: Ở điều kiện tiêu chuẩn, oxy là khí không màu, không mùi và không vị. Khi làm lạnh dưới -183°C (-297°F), oxy trở thành chất lỏng màu xanh nhạt, và dưới -218°C (-361°F), nó kết tinh thành chất rắn.
- Mật độ: Oxy khí có mật độ khoảng 1,429 g/lít ở 0°C và áp suất 1 atm, nặng hơn không khí khoảng 1,1 lần.
- Điểm sôi và điểm nóng chảy: Oxy có điểm nóng chảy -218,4°C (-361,1°F) và điểm sôi -183,0°C (-297,4°F).
- Cấu hình electron: Oxy có cấu hình electron \(1s^2 2s^2 2p^4\), với sáu electron ở lớp vỏ ngoài cùng, làm cho nó có khả năng phản ứng mạnh mẽ với nhiều nguyên tố khác.
- Dạng thù hình: Oxy tồn tại ở hai dạng thù hình: dạng diatomic (O2) và dạng triatomic (O3, ozone). Dạng O2 là dạng phổ biến và ổn định hơn, trong khi dạng O3 đóng vai trò quan trọng trong việc bảo vệ trái đất khỏi tia cực tím từ mặt trời.
- Tính chất hóa học:
- Phản ứng với kim loại: Oxy dễ dàng phản ứng với hầu hết các kim loại để tạo thành oxit kim loại. Ví dụ, phản ứng giữa sắt (Fe) và oxy tạo thành oxit sắt (Fe2O3).
- Phản ứng với phi kim: Oxy cũng phản ứng với nhiều phi kim như carbon để tạo thành oxit phi kim. Ví dụ, phản ứng giữa carbon và oxy tạo thành carbon dioxide (CO2).
- Phản ứng cháy: Oxy là một chất oxi hóa mạnh, tham gia vào quá trình cháy, trong đó nó kết hợp với các chất khác và giải phóng nhiệt và ánh sáng. Các phản ứng cháy như cháy gỗ, cháy nhiên liệu đều cần oxy.
- Vai trò sinh học: Trong sinh học, oxy cần thiết cho quá trình hô hấp tế bào, trong đó các sinh vật sử dụng oxy để chuyển hóa chất hữu cơ thành năng lượng, đồng thời giải phóng CO2.
- Oxy hóa: Oxy có thể gây ra quá trình oxy hóa, một phản ứng hóa học trong đó nó kết hợp với một nguyên tố khác và thay đổi cấu trúc hóa học của chất đó. Đây là quá trình cơ bản xảy ra trong rỉ sét và nhiều quá trình tự nhiên khác.
Nhìn chung, oxy là một trong những nguyên tố hóa học quan trọng nhất với vai trò thiết yếu trong các quá trình sinh học và công nghiệp. Nó đóng góp vào sự sống, sản xuất năng lượng, và nhiều quá trình công nghiệp quan trọng khác.
4. Ứng dụng của Oxy trong đời sống và công nghiệp
Oxy là một nguyên tố hóa học có vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ đời sống hàng ngày đến các ngành công nghiệp lớn. Dưới đây là những ứng dụng phổ biến của oxy:
- Trong y tế:
- Hỗ trợ hô hấp: Oxy được sử dụng rộng rãi trong y tế để hỗ trợ bệnh nhân gặp khó khăn về hô hấp, thông qua các phương pháp như liệu pháp oxy hoặc máy thở.
- Điều trị các tình trạng khẩn cấp: Oxy được cung cấp cho bệnh nhân trong các tình huống cấp cứu, như nhồi máu cơ tim, đột quỵ hoặc chấn thương nặng để duy trì sự sống.
- Sử dụng trong phẫu thuật: Trong quá trình phẫu thuật, oxy được sử dụng để gây mê và duy trì sự hô hấp của bệnh nhân.
- Trong công nghiệp:
- Sản xuất thép và kim loại: Oxy được sử dụng trong lò cao để tăng nhiệt độ và cải thiện hiệu suất trong quá trình luyện kim. Nó giúp đốt cháy tạp chất và tạo ra một sản phẩm kim loại tinh khiết hơn.
- Hàn và cắt kim loại: Oxy được sử dụng trong quá trình hàn oxy-acetylene và cắt kim loại. Oxy giúp tạo ra nhiệt độ cao cần thiết để nóng chảy hoặc cắt qua kim loại.
- Sản xuất hóa chất: Oxy là nguyên liệu quan trọng trong sản xuất nhiều loại hóa chất, bao gồm axit sulfuric, axit nitric và ethylene oxide, được sử dụng rộng rãi trong các ngành công nghiệp khác nhau.
- Trong đời sống hàng ngày:
- Hỗ trợ sự sống: Oxy là khí cần thiết cho sự hô hấp của con người và động vật. Nó cung cấp năng lượng cho các quá trình sinh học cơ bản của sự sống.
- Trong các hệ thống xử lý nước: Oxy được sử dụng để loại bỏ các chất ô nhiễm hữu cơ và khử trùng nước, làm sạch nước uống và nước thải.
- Lặn biển: Các bình oxy được sử dụng bởi thợ lặn để duy trì hơi thở dưới nước trong thời gian dài.
- Trong các ứng dụng khác:
- Du hành không gian: Oxy được sử dụng để cung cấp không khí thở cho phi hành gia trên các tàu vũ trụ và trạm không gian.
- Công nghiệp thực phẩm: Oxy được sử dụng trong các quá trình như đóng gói thực phẩm để kéo dài thời gian bảo quản và ngăn chặn sự phát triển của vi khuẩn.
Oxy là một nguyên tố không thể thiếu trong nhiều lĩnh vực, từ chăm sóc sức khỏe, công nghiệp sản xuất, đến các ứng dụng trong đời sống hàng ngày, đóng vai trò quan trọng trong việc duy trì sự sống và nâng cao chất lượng cuộc sống.

5. Các dạng thù hình của Oxy
Oxy là một nguyên tố có khả năng tồn tại ở nhiều dạng thù hình khác nhau, trong đó nổi bật nhất là hai dạng: Oxy phân tử (O2) và Ozone (O3). Mỗi dạng thù hình này có cấu trúc, tính chất và ứng dụng riêng biệt trong các lĩnh vực khoa học và đời sống.
- Oxy phân tử (O2):
- Cấu trúc: Oxy phân tử là dạng thù hình phổ biến nhất của oxy. Phân tử O2 bao gồm hai nguyên tử oxy liên kết đôi với nhau thông qua liên kết cộng hóa trị. Cấu hình này giúp oxy ổn định ở điều kiện thường.
- Tính chất: O2 là khí không màu, không mùi, không vị và rất dễ phản ứng với các nguyên tố khác. Đây là dạng thù hình mà chúng ta hít thở hàng ngày để duy trì sự sống. Oxy phân tử có tính oxi hóa mạnh, giúp duy trì quá trình cháy và phản ứng hóa học.
- Ứng dụng: O2 được sử dụng rộng rãi trong y tế để hỗ trợ hô hấp, trong các ngành công nghiệp để cắt và hàn kim loại, cũng như trong các hệ thống xử lý nước thải để oxy hóa các chất ô nhiễm.
- Ozone (O3):
- Cấu trúc: Ozone là dạng thù hình khác của oxy, bao gồm ba nguyên tử oxy liên kết với nhau. Ozone có cấu trúc hình chữ V và là một phân tử không ổn định ở nhiệt độ và áp suất thường, dễ dàng phân hủy thành oxy phân tử (O2).
- Tính chất: Ozone là một chất khí màu xanh nhạt, có mùi hắc và rất dễ phân hủy. Nó là một chất oxi hóa cực mạnh, mạnh hơn nhiều so với oxy phân tử (O2), và có khả năng tiêu diệt vi khuẩn, virus, và các tác nhân gây ô nhiễm hữu cơ.
- Ứng dụng: Ozone được sử dụng trong các hệ thống xử lý nước để khử trùng và loại bỏ các chất ô nhiễm hữu cơ, trong công nghiệp thực phẩm để kéo dài thời gian bảo quản, và trong y tế để khử trùng thiết bị. Ngoài ra, tầng ozone trong khí quyển đóng vai trò quan trọng trong việc bảo vệ trái đất khỏi bức xạ cực tím từ mặt trời.
Các dạng thù hình của oxy, đặc biệt là O2 và O3, có vai trò thiết yếu trong nhiều lĩnh vực khoa học và công nghiệp. Việc hiểu rõ các đặc tính và ứng dụng của từng dạng thù hình giúp chúng ta tận dụng hiệu quả nguồn tài nguyên quan trọng này trong cuộc sống hàng ngày.
XEM THÊM:
6. Vai trò của Oxy trong sinh học và môi trường
Oxy là một nguyên tố không thể thiếu đối với mọi hình thức sống trên Trái Đất, đóng vai trò chủ chốt trong các quá trình sinh học và các hiện tượng tự nhiên.
- Tham gia vào quá trình hô hấp: Trong sinh vật, oxy là chất nhận electron cuối cùng trong chuỗi truyền điện tử, một phần của quá trình hô hấp tế bào. Nhờ oxy, các sinh vật có thể chuyển hóa chất dinh dưỡng thành năng lượng, điều này rất quan trọng cho sự sống của các loài động vật, thực vật và vi sinh vật.
- Quá trình quang hợp: Oxy được giải phóng vào khí quyển thông qua quá trình quang hợp của thực vật và tảo. Trong quá trình này, cây xanh sử dụng năng lượng ánh sáng để tách nước (H2O) thành khí oxy (O2) và glucose (C6H12O6), cung cấp nguồn năng lượng cơ bản cho hầu hết các sinh vật sống.
- Chức năng trong hệ sinh thái: Oxy không chỉ quan trọng cho quá trình hô hấp và quang hợp, mà còn ảnh hưởng đến sự cân bằng của hệ sinh thái. Mức độ oxy hòa tan trong nước, ví dụ, quyết định sự sống còn của các loài thủy sinh.
- Bảo vệ môi trường: Oxy cũng tham gia vào quá trình phân hủy sinh học, giúp phân giải các chất hữu cơ thành các dạng dễ tiêu hóa hơn, góp phần vào việc duy trì sạch sẽ môi trường.
Qua đó, có thể thấy rằng oxy không chỉ là thành phần thiết yếu cho sự sống mà còn đóng vai trò quan trọng trong việc duy trì cân bằng tự nhiên và bảo vệ môi trường.
7. Kết luận
Oxy, với cấu hình electron đặc trưng \(1s^2 2s^2 2p^4\), là một nguyên tố thiết yếu và đa năng trong tự nhiên. Vai trò của nó không chỉ dừng lại ở việc duy trì sự sống thông qua quá trình hô hấp và quang hợp, mà còn mở rộng ra các lĩnh vực công nghiệp và môi trường.
- Về mặt sinh học, oxy là thành phần không thể thiếu của nước, chiếm một phần lớn cơ thể sinh vật và tham gia vào các phản ứng hóa học quan trọng như sự phân hủy các chất dinh dưỡng để tạo năng lượng.
- Trong môi trường, oxy góp phần quan trọng trong việc duy trì cân bằng khí quyển, hỗ trợ sự sống của hầu hết các sinh vật sống trên Trái Đất.
- Trong công nghiệp, oxy được sử dụng rộng rãi trong quá trình đốt cháy, sản xuất kim loại, và là nguyên liệu chính trong sản xuất nhiều loại hóa chất quan trọng.
Qua việc hiểu rõ về cấu hình electron và tính chất của oxy, chúng ta có thể đánh giá cao hơn vai trò không thể thiếu của nguyên tố này trong đời sống và ứng dụng công nghệ. Điều này nhấn mạnh tầm quan trọng của việc nghiên cứu và bảo vệ nguồn oxy, đảm bảo sự bền vững cho các thế hệ tương lai.