Chủ đề electron gain enthalpy: Electron Gain Enthalpy là một trong những khái niệm quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về cách các nguyên tử và phân tử tương tác khi nhận thêm electron. Bài viết này sẽ giải thích chi tiết khái niệm, yếu tố ảnh hưởng và các ứng dụng quan trọng của Electron Gain Enthalpy trong nhiều lĩnh vực khác nhau của hóa học.
Mục lục
Electron Gain Enthalpy
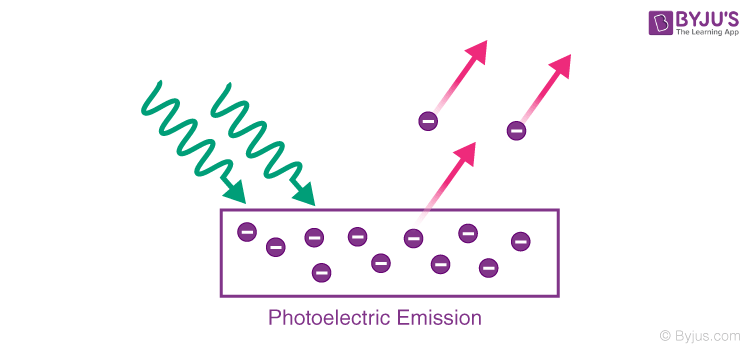
Electron Gain Enthalpy (hay còn gọi là "enthalpy nhận electron") là khái niệm trong hóa học vật lý, mô tả sự thay đổi năng lượng khi một nguyên tử hoặc phân tử trung hòa nhận một electron ở pha khí.
Định nghĩa
Electron gain enthalpy được định nghĩa là năng lượng giải phóng khi một nguyên tử ở trạng thái khí hấp thụ thêm một electron để trở thành ion âm. Giá trị này có thể âm hoặc dương tùy vào đặc điểm của nguyên tố đó.
Các yếu tố ảnh hưởng
- Cấu trúc nguyên tử: Cấu hình electron của nguyên tử ảnh hưởng đến khả năng thu nhận electron. Ví dụ, các nguyên tố halogen thường có enthalpy nhận electron rất cao.
- Bán kính nguyên tử: Nguyên tử có bán kính nhỏ sẽ có lực hút hạt nhân mạnh hơn, dẫn đến giá trị electron gain enthalpy lớn hơn.
- Điện tích hạt nhân: Nguyên tử có điện tích hạt nhân lớn hơn sẽ dễ dàng thu nhận electron hơn do lực hút mạnh.
Một số giá trị electron gain enthalpy điển hình
| Nguyên tố | Electron Gain Enthalpy (kJ/mol) |
|---|---|
| Fluor (F) | -328 |
| Clo (Cl) | -349 |
| Lưu huỳnh (S) | -200 |
| Oxy (O) | -141 |
Ứng dụng
Khái niệm electron gain enthalpy rất quan trọng trong việc hiểu các quá trình hóa học như sự hình thành ion, phản ứng oxy hóa - khử, và cấu trúc phân tử. Nó cũng được sử dụng để giải thích tính chất của các nguyên tố trong bảng tuần hoàn.
Điểm nổi bật
- Giá trị của electron gain enthalpy thường âm, nghĩa là năng lượng được giải phóng khi nguyên tử nhận electron.
- Nguyên tố halogen có giá trị electron gain enthalpy cao nhất do chúng có xu hướng dễ dàng thu nhận electron để đạt cấu hình electron bền vững.
- Electron gain enthalpy giúp xác định tính chất hóa học và mức độ phản ứng của các nguyên tố.
Tổng kết, electron gain enthalpy là một khái niệm quan trọng trong hóa học, giúp giải thích cơ chế phản ứng và đặc tính của các nguyên tố. Các yếu tố như cấu trúc nguyên tử, bán kính nguyên tử, và điện tích hạt nhân đều có tác động lớn đến giá trị electron gain enthalpy của mỗi nguyên tố.
.png)
Định nghĩa Electron Gain Enthalpy
Electron Gain Enthalpy (enthalpy nhận electron) là khái niệm trong hóa học, mô tả sự thay đổi năng lượng khi một nguyên tử hoặc ion ở trạng thái khí trung hòa hấp thụ thêm một electron. Đây là một chỉ số quan trọng để hiểu rõ cách các nguyên tử và ion tương tác với electron trong quá trình hình thành ion âm.
Quá trình thu nhận electron có thể giải phóng hoặc hấp thụ năng lượng, tùy thuộc vào lực hút giữa hạt nhân nguyên tử và electron. Giá trị của electron gain enthalpy có thể âm hoặc dương:
- Giá trị âm: Khi nguyên tử giải phóng năng lượng trong quá trình nhận electron, giá trị electron gain enthalpy là âm. Điều này thường xảy ra ở các nguyên tố có xu hướng nhận electron dễ dàng như các halogen (ví dụ: F, Cl).
- Giá trị dương: Khi nguyên tử phải tiêu thụ năng lượng để nhận electron, giá trị electron gain enthalpy là dương. Điều này thường thấy ở các nguyên tố không dễ dàng thu nhận electron.
Công thức tổng quát mô tả electron gain enthalpy:
$$
\Delta H = E_{final} - E_{initial}
$$
Trong đó:
- ΔH: Sự thay đổi năng lượng, tức electron gain enthalpy
- Efinal: Năng lượng của nguyên tử sau khi nhận electron
- Einitial: Năng lượng của nguyên tử trước khi nhận electron
Một số nguyên tố có electron gain enthalpy rất lớn, như halogen, do xu hướng nhận thêm một electron để hoàn thiện lớp vỏ ngoài cùng của chúng. Ngược lại, các nguyên tố như khí hiếm có giá trị electron gain enthalpy thấp hoặc dương do chúng đã có lớp vỏ electron bền vững.
Yếu tố ảnh hưởng đến Electron Gain Enthalpy
Electron Gain Enthalpy phụ thuộc vào nhiều yếu tố khác nhau trong cấu trúc nguyên tử và điều kiện hóa học. Dưới đây là các yếu tố quan trọng ảnh hưởng đến giá trị của electron gain enthalpy:
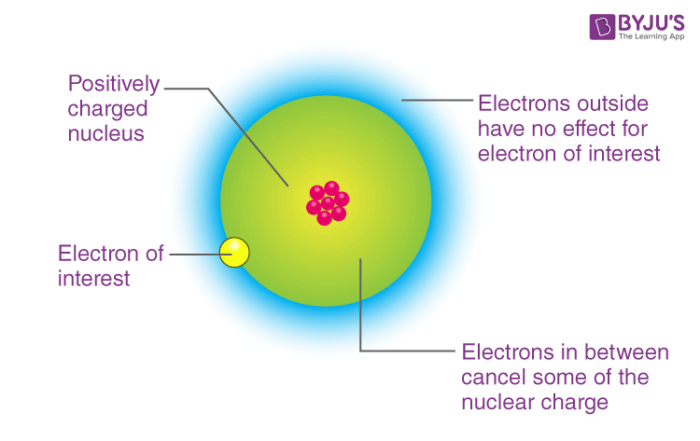
- Bán kính nguyên tử: Nguyên tử có bán kính càng nhỏ, lực hút hạt nhân càng lớn. Điều này làm cho nguyên tử dễ dàng thu hút electron hơn, do đó electron gain enthalpy có giá trị âm lớn hơn. Ngược lại, nguyên tử có bán kính lớn hơn sẽ khó thu nhận electron do lực hút yếu, dẫn đến electron gain enthalpy ít âm hơn.
- Điện tích hạt nhân: Lực hút của hạt nhân với electron phụ thuộc vào điện tích hạt nhân. Nguyên tử có điện tích hạt nhân cao sẽ thu hút electron mạnh hơn, làm tăng giá trị âm của electron gain enthalpy. Tuy nhiên, nếu điện tích quá cao, có thể cần năng lượng để vượt qua lực đẩy giữa các electron, làm cho giá trị enthalpy giảm đi.
- Cấu hình electron: Cấu trúc của các lớp vỏ electron có ảnh hưởng lớn đến việc nguyên tử có dễ dàng thu nhận electron hay không. Những nguyên tử có cấu hình electron gần bền vững, chẳng hạn như các nguyên tố thuộc nhóm halogen, có xu hướng thu hút electron mạnh mẽ hơn, dẫn đến giá trị electron gain enthalpy âm lớn. Trái lại, những nguyên tử có cấu hình electron bền vững, chẳng hạn như khí hiếm, có giá trị electron gain enthalpy dương hoặc rất thấp.
- Lớp electron ngoài cùng: Nếu lớp electron ngoài cùng đã đầy hoặc gần đầy, nguyên tử có xu hướng thu nhận electron dễ dàng hơn, dẫn đến electron gain enthalpy âm. Ngược lại, nếu lớp electron ngoài cùng có ít electron, khả năng nhận electron sẽ thấp hơn.
- Hiệu ứng chắn (shielding effect): Các electron ở lớp vỏ trong sẽ che chắn một phần lực hút hạt nhân đối với electron ngoài cùng. Hiệu ứng chắn càng mạnh thì lực hút hạt nhân lên electron càng yếu, dẫn đến electron gain enthalpy ít âm hơn.
Tóm lại, các yếu tố như bán kính nguyên tử, điện tích hạt nhân, cấu hình electron và hiệu ứng chắn đều có vai trò quan trọng trong việc xác định giá trị electron gain enthalpy. Những yếu tố này kết hợp lại sẽ giúp giải thích tại sao các nguyên tố khác nhau có giá trị electron gain enthalpy khác nhau.

So sánh Electron Gain Enthalpy giữa các nguyên tố
Electron Gain Enthalpy của các nguyên tố có sự khác biệt lớn, tùy thuộc vào vị trí của chúng trong bảng tuần hoàn và cấu trúc nguyên tử. Dưới đây là sự so sánh Electron Gain Enthalpy giữa một số nhóm nguyên tố quan trọng:
1. Halogen
Các nguyên tố halogen (F, Cl, Br, I) có giá trị Electron Gain Enthalpy rất cao và thường là âm. Điều này là do chúng chỉ cần một electron nữa để hoàn thiện lớp vỏ electron ngoài cùng, đạt cấu hình bền vững.
- Fluor (F): -328 kJ/mol
- Clo (Cl): -349 kJ/mol
- Brom (Br): -324 kJ/mol
- Iot (I): -295 kJ/mol
Điều đáng chú ý là, mặc dù Fluor có kích thước nhỏ hơn Clo, Clo lại có giá trị Electron Gain Enthalpy âm lớn hơn. Điều này là do sự ảnh hưởng của mật độ electron cao xung quanh Fluor gây ra lực đẩy giữa các electron, làm giảm giá trị Electron Gain Enthalpy của Fluor.
2. Kim loại kiềm
Các kim loại kiềm (Li, Na, K, Rb, Cs) có giá trị Electron Gain Enthalpy thấp hơn nhiều so với halogen, và thường là dương hoặc rất gần bằng 0. Điều này là do kim loại kiềm có xu hướng mất electron để tạo thành ion dương, thay vì nhận thêm electron.
- Liti (Li): -60 kJ/mol
- Natri (Na): -53 kJ/mol
- Kali (K): -48 kJ/mol
Các kim loại kiềm có lớp vỏ ngoài cùng với một electron duy nhất, do đó chúng không có xu hướng nhận electron mà thích mất đi electron để đạt cấu hình bền vững hơn.
3. Khí hiếm
Khí hiếm (He, Ne, Ar, Kr, Xe) có Electron Gain Enthalpy dương hoặc rất gần bằng 0 do chúng có cấu hình electron rất bền vững, với lớp vỏ ngoài cùng đã đầy đủ. Do đó, các nguyên tố này không dễ dàng nhận thêm electron.
- Heli (He): +48 kJ/mol
- Neon (Ne): +116 kJ/mol
- Argon (Ar): +96 kJ/mol
Kết luận
Electron Gain Enthalpy của các nguyên tố có sự khác biệt rõ ràng, tùy thuộc vào vị trí trong bảng tuần hoàn và cấu trúc electron của chúng. Các halogen có giá trị Electron Gain Enthalpy lớn nhất do xu hướng nhận electron mạnh mẽ, trong khi các kim loại kiềm và khí hiếm có giá trị thấp hoặc dương, phản ánh tính chất hóa học của chúng.

Ứng dụng của Electron Gain Enthalpy trong hóa học
Electron Gain Enthalpy là một khái niệm quan trọng trong hóa học và có nhiều ứng dụng trong việc phân tích và dự đoán tính chất của các nguyên tố và hợp chất. Dưới đây là một số ứng dụng nổi bật:
- Dự đoán tính chất hóa học của nguyên tố: Electron Gain Enthalpy giúp các nhà hóa học dự đoán tính chất của các nguyên tố, đặc biệt là khả năng nhận thêm electron để tạo thành ion âm. Nguyên tố có giá trị electron gain enthalpy âm lớn thường có xu hướng nhận thêm electron để hoàn thiện lớp vỏ electron ngoài cùng, chẳng hạn như các nguyên tố nhóm halogen. Ngược lại, những nguyên tố có giá trị electron gain enthalpy dương hoặc thấp, chẳng hạn như các khí hiếm, rất khó nhận thêm electron.
- Ứng dụng trong phản ứng oxy hóa - khử: Electron Gain Enthalpy có vai trò quan trọng trong các phản ứng oxy hóa - khử, đặc biệt là các phản ứng liên quan đến sự chuyển đổi giữa các ion. Những nguyên tố hoặc hợp chất có giá trị electron gain enthalpy âm cao có xu hướng bị khử (nhận electron), do đó chúng thường là chất oxy hóa mạnh. Ngược lại, những nguyên tố có electron gain enthalpy thấp hoặc dương thường tham gia vào phản ứng oxi hóa, nhường electron để đạt cấu hình bền vững hơn.
- Hình thành ion âm: Electron Gain Enthalpy giúp dự đoán khả năng hình thành ion âm trong các phản ứng hóa học. Nguyên tố có giá trị electron gain enthalpy âm lớn sẽ dễ dàng hình thành ion âm khi nhận thêm electron. Ví dụ, các nguyên tố halogen như Clo (Cl) dễ dàng hình thành ion Cl- do giá trị electron gain enthalpy âm cao.
- Thiết kế vật liệu hóa học: Các nhà nghiên cứu sử dụng electron gain enthalpy để thiết kế các vật liệu mới, bao gồm các chất xúc tác và chất bán dẫn. Bằng cách hiểu rõ giá trị electron gain enthalpy của các nguyên tố, người ta có thể tối ưu hóa các tính chất điện tử của vật liệu, từ đó nâng cao hiệu suất và tính ổn định của chúng trong các ứng dụng thực tiễn.
- Xác định hoạt tính của hợp chất: Electron Gain Enthalpy cũng giúp xác định hoạt tính của hợp chất trong môi trường hóa học khác nhau. Những hợp chất có khả năng nhận electron mạnh thường có hoạt tính cao trong các phản ứng hóa học, đặc biệt là các phản ứng liên quan đến trao đổi electron.
Tóm lại, Electron Gain Enthalpy là một công cụ quan trọng trong hóa học, cho phép chúng ta dự đoán và hiểu rõ hơn về tính chất và hành vi của các nguyên tố trong phản ứng hóa học. Khả năng kiểm soát và ứng dụng thông tin này đã giúp cải tiến các quá trình và vật liệu hóa học trong nhiều lĩnh vực công nghệ.

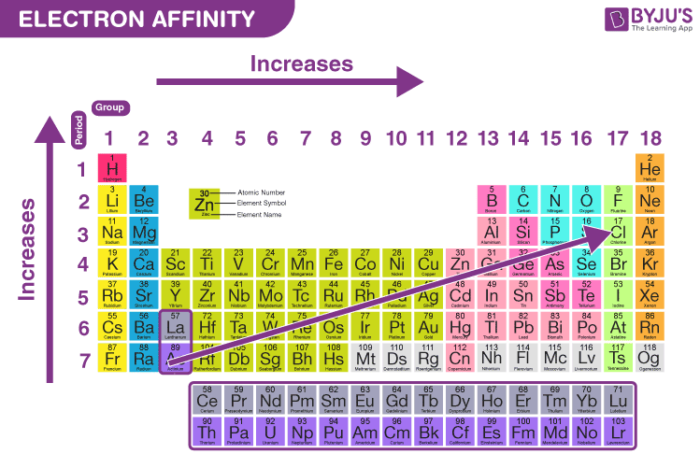
Xu hướng Electron Gain Enthalpy trong bảng tuần hoàn
Xu hướng của Electron Gain Enthalpy trong bảng tuần hoàn được xác định bởi vị trí của các nguyên tố và các yếu tố như bán kính nguyên tử, điện tích hạt nhân và cấu hình electron. Dưới đây là các xu hướng chính:
1. Xu hướng theo chu kỳ
Trong một chu kỳ từ trái sang phải của bảng tuần hoàn, giá trị Electron Gain Enthalpy thường có xu hướng trở nên âm hơn (tăng). Điều này là do bán kính nguyên tử giảm khi điện tích hạt nhân tăng, khiến lực hút giữa hạt nhân và electron mạnh hơn, giúp nguyên tử dễ dàng nhận electron hơn.
- Ví dụ: Các nguyên tố nhóm halogen (F, Cl, Br) có giá trị Electron Gain Enthalpy âm nhất trong chu kỳ do xu hướng nhận thêm một electron để đạt cấu hình bền vững của khí hiếm.
2. Xu hướng theo nhóm
Khi di chuyển từ trên xuống dưới trong một nhóm của bảng tuần hoàn, giá trị Electron Gain Enthalpy có xu hướng ít âm hơn (giảm). Điều này là do bán kính nguyên tử tăng khi số lớp electron tăng, dẫn đến lực hút giữa hạt nhân và electron ngoài cùng yếu đi.
- Ví dụ: Trong nhóm halogen, Fluor có giá trị Electron Gain Enthalpy âm lớn nhất, trong khi Iod có giá trị ít âm hơn do kích thước nguyên tử lớn hơn.
3. Ngoại lệ của xu hướng
Có một số ngoại lệ đối với xu hướng chung của Electron Gain Enthalpy trong bảng tuần hoàn. Điển hình là sự chênh lệch giữa giá trị của Fluor và Clo. Mặc dù Fluor nhỏ hơn, nhưng Clo lại có Electron Gain Enthalpy âm hơn. Điều này là do mật độ electron xung quanh nguyên tử Fluor lớn, gây ra lực đẩy giữa các electron, làm giảm khả năng thu nhận thêm electron.
Khí hiếm là một nhóm nguyên tố khác có ngoại lệ. Các nguyên tố này có cấu hình electron hoàn chỉnh, do đó giá trị Electron Gain Enthalpy của chúng thường rất thấp hoặc thậm chí dương, vì chúng không có xu hướng nhận thêm electron.
Kết luận
Xu hướng Electron Gain Enthalpy trong bảng tuần hoàn thể hiện sự thay đổi theo chu kỳ và theo nhóm, nhưng vẫn có những ngoại lệ đáng chú ý. Việc hiểu rõ các xu hướng này giúp các nhà hóa học dự đoán được hành vi của nguyên tố trong các phản ứng hóa học và thiết kế các vật liệu và hợp chất mới dựa trên tính chất của chúng.







:max_bytes(150000):strip_icc()/Calcium-58b602433df78cdcd83d4c16.jpg)