Chủ đề electron geometry vs molecular geometry: Electron Geometry và Molecular Geometry là hai khái niệm quan trọng trong hóa học giúp chúng ta hiểu rõ về cấu trúc và tính chất của phân tử. Bài viết này sẽ khám phá sự khác biệt giữa chúng, cung cấp các ví dụ minh họa chi tiết và ứng dụng thực tế trong việc dự đoán hình dạng phân tử.
Mục lục
- Electron Geometry và Molecular Geometry
- Tổng quan về Electron Geometry và Molecular Geometry
- Sự khác biệt giữa Electron Geometry và Molecular Geometry
- Các loại Electron Geometry cơ bản
- Các loại Molecular Geometry phổ biến
- Ứng dụng của Electron Geometry và Molecular Geometry trong hóa học
- Ví dụ minh họa về Electron Geometry và Molecular Geometry
Electron Geometry và Molecular Geometry
Khi học về hóa học, hai khái niệm quan trọng cần nắm rõ là "Electron Geometry" (hình học electron) và "Molecular Geometry" (hình học phân tử). Hai khái niệm này tuy liên quan mật thiết nhưng có sự khác biệt nhất định. Hiểu rõ sự khác biệt này sẽ giúp chúng ta có cái nhìn sâu sắc hơn về cấu trúc và tính chất của các phân tử.
Hình học Electron (Electron Geometry)
Hình học electron đề cập đến cách sắp xếp của các cặp electron xung quanh nguyên tử trung tâm trong một phân tử hoặc ion. Cách sắp xếp này bao gồm cả các cặp electron liên kết và các cặp electron tự do (không liên kết). Hình học electron không chỉ ảnh hưởng đến cấu trúc mà còn đến độ bền và tính chất hóa học của phân tử.
- Ví dụ: Trong phân tử CH4 (methane), có bốn cặp electron liên kết với bốn nguyên tử hydro, tạo thành hình tứ diện (tetrahedral).
Hình học Phân tử (Molecular Geometry)
Hình học phân tử chỉ mô tả hình dạng thực tế của phân tử, tức là hình dạng được tạo ra chỉ bởi các nguyên tử trong phân tử mà không tính đến các cặp electron tự do. Do đó, hình học phân tử có thể khác với hình học electron nếu có sự hiện diện của cặp electron tự do.
- Ví dụ: Trong phân tử H2O (nước), có hai cặp electron tự do trên nguyên tử oxy. Do đó, mặc dù hình học electron là tứ diện, hình học phân tử thực tế là hình chữ V (bent).
Sự khác biệt chính
Sự khác biệt chính giữa hình học electron và hình học phân tử nằm ở chỗ hình học electron xem xét tất cả các cặp electron, bao gồm cả cặp electron tự do, trong khi hình học phân tử chỉ tập trung vào vị trí của các nguyên tử. Điều này dẫn đến sự khác biệt trong hình dạng của các phân tử khi có sự hiện diện của cặp electron tự do.
Bảng So Sánh
| Đặc điểm | Hình học Electron | Hình học Phân tử |
|---|---|---|
| Sự bao gồm | Các cặp electron liên kết và không liên kết | Chỉ các nguyên tử trong phân tử |
| Ảnh hưởng của cặp electron tự do | Có tính đến | Không tính đến |
| Ví dụ điển hình | Tứ diện (trong CH4) | Hình chữ V (trong H2O) |
Kết luận
Việc hiểu rõ cả hai khái niệm này là cực kỳ quan trọng trong việc dự đoán và giải thích hình dạng, tính chất của các phân tử. Hình học electron giúp chúng ta hiểu cách các cặp electron được sắp xếp xung quanh nguyên tử trung tâm, trong khi hình học phân tử lại cho chúng ta cái nhìn trực quan về hình dạng thực tế của phân tử.

.png)
Tổng quan về Electron Geometry và Molecular Geometry
Trong hóa học, việc hiểu rõ cấu trúc phân tử là rất quan trọng để dự đoán và giải thích các tính chất vật lý và hóa học của chất. Hai khái niệm cốt lõi giúp chúng ta phân tích cấu trúc phân tử là Electron Geometry (hình học electron) và Molecular Geometry (hình học phân tử). Mặc dù có liên quan chặt chẽ với nhau, hai khái niệm này có sự khác biệt cơ bản, giúp mô tả cấu trúc phân tử từ các góc độ khác nhau.
Electron Geometry đề cập đến sự sắp xếp trong không gian của tất cả các cặp electron xung quanh nguyên tử trung tâm, bao gồm cả các cặp electron liên kết và cặp electron tự do (không liên kết). Điều này cung cấp cái nhìn tổng quan về hình dạng cơ bản của đám mây electron xung quanh nguyên tử trung tâm.
Molecular Geometry lại tập trung vào sự sắp xếp không gian của các nguyên tử trong phân tử, bỏ qua các cặp electron tự do. Điều này mô tả hình dạng thực tế của phân tử, tức là vị trí của các nguyên tử tạo nên phân tử.
- Ví dụ, trong phân tử (methane), cả Electron Geometry và Molecular Geometry đều là tứ diện (tetrahedral) vì không có cặp electron tự do.
- Tuy nhiên, trong phân tử (nước), Electron Geometry là tứ diện, nhưng Molecular Geometry là hình chữ V (bent) do có hai cặp electron tự do trên nguyên tử oxy.
Việc hiểu rõ hai khái niệm này giúp chúng ta dự đoán chính xác hơn về hình dạng của các phân tử và các tương tác hóa học có thể xảy ra, từ đó giải thích được nhiều hiện tượng hóa học phức tạp.
Sự khác biệt giữa Electron Geometry và Molecular Geometry
Trong hóa học, Electron Geometry và Molecular Geometry là hai khái niệm quan trọng nhưng có sự khác biệt đáng kể. Hiểu rõ sự khác biệt này giúp chúng ta nắm vững cách các phân tử được hình thành và tương tác.
Electron Geometry tập trung vào sự sắp xếp của tất cả các cặp electron xung quanh nguyên tử trung tâm, bao gồm cả các cặp electron liên kết và không liên kết. Nó cung cấp một cái nhìn tổng quan về hình dạng đám mây electron và ảnh hưởng của các cặp electron tự do đến cấu trúc phân tử.
Molecular Geometry, ngược lại, chỉ xem xét sự sắp xếp không gian của các nguyên tử trong phân tử. Molecular Geometry không tính đến sự hiện diện của các cặp electron tự do, mà chỉ mô tả hình dạng thực tế của phân tử dựa trên vị trí của các nguyên tử.
- Ví dụ, trong phân tử (methane), Electron Geometry và Molecular Geometry đều là hình tứ diện vì không có cặp electron tự do.
- Tuy nhiên, trong phân tử (ammonia), Electron Geometry là hình tứ diện, nhưng Molecular Geometry là hình kim tự tháp tam giác (trigonal pyramidal) do có một cặp electron tự do.
- Đối với phân tử (nước), Electron Geometry là tứ diện, nhưng Molecular Geometry lại là hình chữ V (bent) vì có hai cặp electron tự do.
Sự khác biệt chính giữa hai khái niệm này nằm ở chỗ Electron Geometry xem xét toàn bộ các cặp electron (bao gồm cả các cặp tự do), trong khi Molecular Geometry chỉ quan tâm đến các nguyên tử. Điều này có nghĩa là hình dạng thực tế của phân tử (Molecular Geometry) có thể bị biến đổi so với hình dạng dự đoán dựa trên Electron Geometry do sự đẩy giữa các cặp electron tự do và các nguyên tử liên kết.
Hiểu rõ sự khác biệt này giúp chúng ta dự đoán chính xác hơn về cấu trúc phân tử, từ đó giải thích được nhiều đặc tính hóa học và vật lý của các chất.

Các loại Electron Geometry cơ bản
Trong hóa học, Electron Geometry mô tả cách các cặp electron, bao gồm cả các cặp liên kết và không liên kết, sắp xếp xung quanh nguyên tử trung tâm của một phân tử. Dưới đây là các loại Electron Geometry cơ bản, mỗi loại tương ứng với một sự sắp xếp khác nhau của các cặp electron:
-
Hình học thẳng (Linear)
Trong cấu trúc này, có hai cặp electron xung quanh nguyên tử trung tâm, và chúng được sắp xếp sao cho chúng ở xa nhau nhất có thể, tạo thành một đường thẳng với góc liên kết 180°. Ví dụ điển hình là phân tử carbon dioxide ().
-
Hình học tam giác phẳng (Trigonal Planar)
Khi có ba cặp electron xung quanh nguyên tử trung tâm, chúng sẽ được sắp xếp trong một mặt phẳng và tạo thành một hình tam giác với góc liên kết 120°. Một ví dụ về hình học này là phân tử boron trifluoride ().
-
Hình học tứ diện (Tetrahedral)
Nếu có bốn cặp electron xung quanh nguyên tử trung tâm, chúng sẽ tạo thành một hình tứ diện với góc liên kết khoảng 109.5°. Phân tử methane () là một ví dụ tiêu biểu của hình học này.
-
Hình học lưỡng tháp tam giác (Trigonal Bipyramidal)
Trong trường hợp có năm cặp electron, ba cặp trong số đó sẽ nằm trong một mặt phẳng, tạo thành một tam giác phẳng, và hai cặp còn lại nằm trên và dưới mặt phẳng này, tạo thành cấu trúc lưỡng tháp. Một ví dụ là phân tử phosphorus pentachloride ().
-
Hình học bát diện (Octahedral)
Khi có sáu cặp electron, chúng sẽ sắp xếp trong không gian theo hình bát diện, với các cặp electron ở các góc đối diện nhau trong không gian. Phân tử sulfur hexafluoride () là một ví dụ điển hình.
Mỗi loại Electron Geometry đóng vai trò quan trọng trong việc xác định hình dạng và tính chất của các phân tử, giúp dự đoán cấu trúc không gian của chúng dựa trên sự sắp xếp của các cặp electron.

Các loại Molecular Geometry phổ biến
Molecular Geometry mô tả hình dạng thực tế của một phân tử, dựa trên vị trí của các nguyên tử trong không gian. Dưới đây là các loại Molecular Geometry phổ biến, mỗi loại được xác định bởi số lượng các cặp electron liên kết xung quanh nguyên tử trung tâm và sự hiện diện hoặc không của các cặp electron tự do.
-
Hình học thẳng (Linear)
Hình dạng này xảy ra khi có hai cặp electron liên kết và không có cặp electron tự do trên nguyên tử trung tâm. Các nguyên tử liên kết được sắp xếp thẳng hàng với góc liên kết 180°. Ví dụ điển hình là phân tử carbon dioxide ().
-
Hình học tam giác phẳng (Trigonal Planar)
Khi có ba cặp electron liên kết và không có cặp electron tự do, các nguyên tử sẽ nằm trong một mặt phẳng, tạo thành một hình tam giác với góc liên kết 120°. Một ví dụ về hình học này là phân tử boron trifluoride ().
-
Hình học tứ diện (Tetrahedral)
Nếu có bốn cặp electron liên kết và không có cặp electron tự do, các nguyên tử sẽ tạo thành một hình tứ diện với góc liên kết khoảng 109.5°. Phân tử methane () là một ví dụ tiêu biểu của hình học này.
-
Hình học kim tự tháp tam giác (Trigonal Pyramidal)
Khi có ba cặp electron liên kết và một cặp electron tự do, các nguyên tử sẽ tạo thành một hình kim tự tháp với góc liên kết nhỏ hơn 109.5°. Phân tử ammonia () là một ví dụ phổ biến.
-
Hình học chữ V (Bent)
Hình dạng này xảy ra khi có hai cặp electron liên kết và một hoặc hai cặp electron tự do. Các cặp electron tự do đẩy các cặp electron liên kết, làm cho phân tử có hình chữ V. Ví dụ điển hình là phân tử nước (), với góc liên kết khoảng 104.5°.
-
Hình học lưỡng tháp tam giác (Trigonal Bipyramidal)
Trong trường hợp có năm cặp electron liên kết và không có cặp electron tự do, các nguyên tử sẽ sắp xếp thành hình lưỡng tháp tam giác với các góc liên kết 90° và 120°. Ví dụ là phân tử phosphorus pentachloride ().
-
Hình học bát diện (Octahedral)
Nếu có sáu cặp electron liên kết và không có cặp electron tự do, các nguyên tử sẽ tạo thành một hình bát diện với các góc liên kết 90°. Phân tử sulfur hexafluoride () là ví dụ điển hình.
Những loại hình học phân tử này giúp chúng ta hiểu rõ hơn về cấu trúc không gian của các phân tử và giải thích các đặc tính hóa học cũng như vật lý của chúng.

Ứng dụng của Electron Geometry và Molecular Geometry trong hóa học
Electron Geometry và Molecular Geometry là hai khái niệm quan trọng trong hóa học, giúp giải thích hình dạng của các phân tử và các đặc tính liên quan của chúng. Hiểu rõ về hai khái niệm này có thể giúp dự đoán và giải thích các tính chất vật lý, hóa học của phân tử, cũng như các phản ứng hóa học mà chúng có thể tham gia.
Dự đoán hình dạng phân tử
Electron Geometry và Molecular Geometry được sử dụng để dự đoán hình dạng của phân tử. Khi biết số lượng cặp electron xung quanh nguyên tử trung tâm, ta có thể sử dụng lý thuyết VSEPR (Valence Shell Electron Pair Repulsion) để xác định hình dạng của phân tử. Ví dụ:
- Trong phân tử Methane (CH4), nguyên tử Carbon ở giữa có 4 cặp electron liên kết với các nguyên tử Hydro, tạo ra hình tứ diện.
- Trong phân tử Nước (H2O), nguyên tử Oxygen có 2 cặp electron không liên kết và 2 cặp electron liên kết với các nguyên tử Hydro, tạo ra hình dạng chữ V.
Giải thích tính chất vật lý và hóa học của phân tử
Hình dạng của phân tử ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của nó. Các ứng dụng cụ thể bao gồm:
- Độ phân cực: Hình dạng của phân tử sẽ xác định sự phân bố electron, từ đó ảnh hưởng đến tính phân cực của phân tử. Chẳng hạn, trong phân tử nước, hình dạng chữ V dẫn đến phân tử có cực, tạo nên các tính chất như độ hòa tan cao trong nước.
- Năng lượng tương tác: Hình dạng phân tử còn quyết định cách các phân tử tương tác với nhau, từ đó ảnh hưởng đến các tính chất như điểm sôi, điểm nóng chảy và áp suất hơi.
- Phản ứng hóa học: Hình dạng phân tử ảnh hưởng đến cách các phân tử phản ứng với nhau, từ đó quyết định tốc độ phản ứng và sản phẩm tạo thành.
Tối ưu hóa cấu trúc phân tử trong tổng hợp hóa học
Trong tổng hợp hóa học, việc hiểu rõ Electron Geometry và Molecular Geometry có thể giúp các nhà hóa học tối ưu hóa cấu trúc phân tử để đạt được hiệu quả cao nhất trong các phản ứng. Điều này đặc biệt quan trọng trong việc thiết kế các phân tử mới với tính chất mong muốn, chẳng hạn như các dược phẩm hoặc vật liệu mới.
XEM THÊM:
Ví dụ minh họa về Electron Geometry và Molecular Geometry
Để hiểu rõ hơn về sự khác biệt giữa Electron Geometry và Molecular Geometry, chúng ta cùng xem xét một số ví dụ cụ thể dưới đây:
Ví dụ về Methane (CH4)
Trong phân tử Methane (CH4), nguyên tử carbon ở trung tâm liên kết với bốn nguyên tử hydro. Số lượng các cặp electron liên kết quanh carbon là 4, không có cặp electron đơn lẻ (lone pair). Theo lý thuyết VSEPR, các cặp electron này đẩy nhau và đạt được hình dạng không gian tối ưu là hình tứ diện (tetrahedral). Do đó:
- Electron Geometry: Tứ diện (Tetrahedral).
- Molecular Geometry: Tứ diện (Tetrahedral).
Ví dụ về Nước (H2O)
Trong phân tử nước (H2O), nguyên tử oxy ở trung tâm liên kết với hai nguyên tử hydro và có hai cặp electron đơn lẻ. Do sự hiện diện của các cặp electron đơn lẻ, chúng tạo ra lực đẩy lớn hơn, làm biến dạng góc liên kết giữa các nguyên tử hydro và oxy. Kết quả là:
- Electron Geometry: Tứ diện (Tetrahedral).
- Molecular Geometry: Hình chữ V (Bent).
Ví dụ về Ammonia (NH3)
Trong phân tử Ammonia (NH3), nguyên tử nitrogen ở trung tâm liên kết với ba nguyên tử hydro và có một cặp electron đơn lẻ. Các cặp electron đẩy nhau và kết quả là hình dạng không gian của phân tử là:
- Electron Geometry: Tứ diện (Tetrahedral).
- Molecular Geometry: Hình kim tự tháp tam giác (Trigonal Pyramidal).
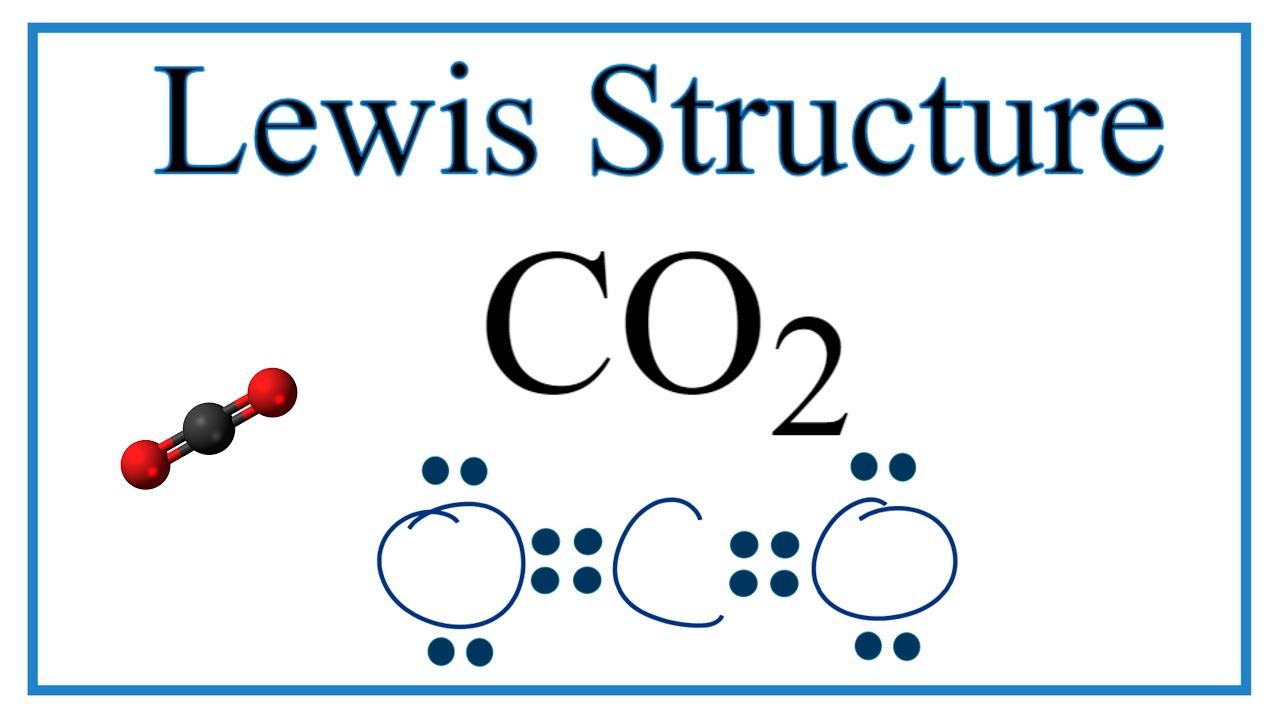
Ví dụ về Carbon Dioxide (CO2)
Trong phân tử Carbon Dioxide (CO2), nguyên tử carbon ở trung tâm liên kết với hai nguyên tử oxy thông qua các liên kết đôi. Không có cặp electron đơn lẻ quanh carbon, dẫn đến:
- Electron Geometry: Thẳng (Linear).
- Molecular Geometry: Thẳng (Linear).









:max_bytes(150000):strip_icc()/Calcium-58b602433df78cdcd83d4c16.jpg)