Contents
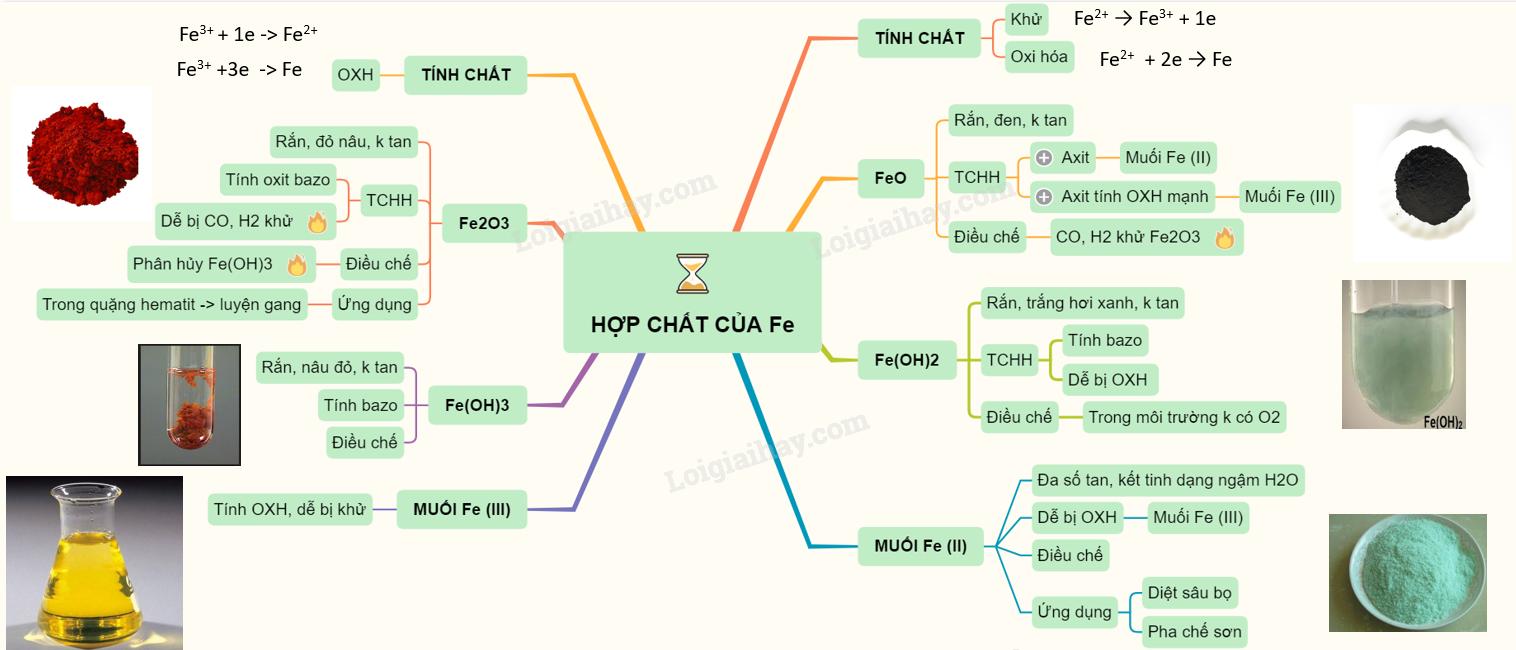
Sắt (II)
Sắt có hai trạng thái oxi hóa chính: Fe2+ và Fe3+. Fe2+ có tính khử, chuyển đổi thành Fe3+ bằng cách nhận một electron. Ngược lại, Fe2+ có tính oxi hóa và chuyển đổi thành Fe bằng cách nhường hai electron.
Có thể bạn quan tâm
1. Oxit FeO
- Oxit FeO là một chất rắn màu đen, không tự nhiên tồn tại và không tan trong nước.
- Oxit FeO tác dụng với axit để tạo ra muối sắt (II), nhưng khi tác dụng với axit có tính oxi hóa mạnh, thu được muối sắt (III).
- Ví dụ: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
- Oxit FeO có thể được điều chế bằng cách khử sắt (III) oxit bằng CO hoặc H2 ở nhiệt độ 500oC: Fe2O3 + CO → 2FeO + CO2
2. Hidroxit Fe(OH)2
- Hidroxit Fe(OH)2 là một chất rắn màu trắng xanh nhạt, không tan trong nước.
- Nó dễ bị oxi hóa thành sắt (III) hiđroxit màu nâu đỏ khi tiếp xúc với không khí.
- Hidroxit Fe(OH)2 có tính bazơ và tác dụng với axit (HCl, H2SO4 loãng) để tạo muối sắt (II).
- Để thu được sản phẩm tinh khiết, hidroxit Fe(OH)2 cần được điều chế trong môi trường không có oxi.
3. Muối sắt (II)
- Đa số muối sắt (II) tan trong nước và tạo thành dạng ngậm nước khi kết tinh.
- Nó dễ bị oxi hóa thành muối sắt (III).
- Ví dụ: 2FeCl2 + Cl2 → 2FeCl3
- Chú ý: Dung dịch muối sắt (II) cần được sử dụng ngay, vì trong không khí muối sắt (II) sẽ chuyển dần thành muối sắt (III).
- Muối sắt (II) có thể được điều chế bằng cách cho Fe (hoặc FeO, Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng:
- Fe + 2HCl → FeCl2 + H2
- FeO + H2SO4 → FeSO4 + H2
- Muối FeSO4 được ứng dụng làm chất diệt sâu bọ, pha chế sơn, và nhuộm vải.
.png)
Làm Chủ BIM: Bí Quyết Chiến Thắng Mọi Gói Thầu Xây Dựng
Sắt (III)
Sắt (III) có tính oxi hóa, tác dụng với một số kim loại và một số hợp chất có tính khử. Fe3+ nhận một electron để chuyển thành Fe2+ hoặc ba electron để chuyển thành Fe.
Bạn đang xem: Lý thuyết về hợp chất của sắt
1. Oxit Fe2O3
- Oxit Fe2O3 là một chất rắn màu đỏ nâu, không tan trong nước.
- Nó dễ tan trong dung dịch axit mạnh.
- Ở nhiệt độ cao, Fe2O3 có thể bị khử bằng CO hoặc H2 thành Fe.
- Oxit Fe2O3 tồn tại trong tự nhiên dưới dạng quặng hemantit và được sử dụng trong quá trình luyện gang.
2. Hidroxit Fe(OH)3
- Hidroxit Fe(OH)3 là một chất rắn màu nâu đỏ, không tan trong nước nhưng dễ tan trong các dung dịch axit để tạo muối sắt (III).
- Ví dụ: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
- Hidroxit Fe(OH)3 có thể được điều chế bằng cách cho dung dịch kiềm tác dụng với muối sắt (III).
- Ví dụ: FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
3. Muối sắt (III)
- Các muối sắt (III) có tính oxi hóa và dễ bị khử thành muối sắt (II).
- Ví dụ: Fe + 2FeCl3 → 3FeCl2
- Bột đồng tan trong dung dịch muối sắt (III).
- Ví dụ: Cu + 2FeCl3 → CuCl2 + FeCl2
⇒ Dung dịch CuCl2 (màu xanh) và dung dịch FeCl2 (không màu) tạo thành dung dịch màu xanh.
Loigiaihay.com
Nguồn: https://ispacedanang.edu.vn
Danh mục: Học tư duy