Chủ đề ôn tập chương nguyên tử: Ôn tập chương nguyên tử là bước quan trọng để nắm vững kiến thức hóa học lớp 10. Bài viết này cung cấp một hướng dẫn chi tiết và toàn diện, giúp bạn hệ thống lại các kiến thức từ cấu tạo nguyên tử đến cấu hình electron, kèm theo các bài tập thực hành để chuẩn bị tốt cho kỳ thi.
Mục lục
Ôn Tập Chương Nguyên Tử - Hóa Học Lớp 10
Chương "Nguyên Tử" trong chương trình Hóa học lớp 10 bao gồm các kiến thức cơ bản về cấu tạo nguyên tử, cấu hình electron, và các nguyên lý, quy tắc cơ bản trong hóa học nguyên tử. Dưới đây là tổng hợp chi tiết các nội dung cần ôn tập:
I. Cấu Tạo Nguyên Tử
- Các hạt cơ bản trong nguyên tử: Nguyên tử gồm ba loại hạt cơ bản: proton, neutron, và electron.
- Số hiệu nguyên tử: Là số proton trong hạt nhân của nguyên tử, ký hiệu là \(Z\).
- Số khối: Là tổng số proton và neutron trong hạt nhân, ký hiệu là \(A\).
- Đồng vị: Các nguyên tử của cùng một nguyên tố có cùng số proton nhưng khác số neutron.
II. Cấu Hình Electron
- Nguyên lý Pauli: Trong một nguyên tử, không thể có hai electron có cùng bộ bốn số lượng tử.
- Nguyên lý Aufbau: Electron chiếm các orbital theo thứ tự năng lượng tăng dần từ thấp lên cao.
- Quy tắc Hund: Trong một phân lớp, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là nhiều nhất.
- Cấu hình electron: Cách sắp xếp electron trong các phân lớp của nguyên tử.
III. Luyện Tập và Ứng Dụng
- Xác định cấu hình electron của các nguyên tố từ số hiệu nguyên tử \(Z\).
- Viết cấu hình electron đầy đủ và cấu hình electron rút gọn của các nguyên tố.
- Áp dụng các quy tắc và nguyên lý vào việc xác định cấu trúc electron của nguyên tử.
- Giải các bài tập liên quan đến đồng vị, tính số hạt cơ bản trong nguyên tử.
IV. Một Số Dạng Bài Tập Thường Gặp
- Viết cấu hình electron của nguyên tử.
- Tính số khối và xác định đồng vị của các nguyên tố.
- Giải các bài tập liên quan đến xác định số lượng hạt proton, neutron, electron trong nguyên tử.
V. Đề Cương Ôn Tập
Để củng cố kiến thức, học sinh nên thực hiện các bài tập ôn tập, tham khảo các đề cương ôn thi học kỳ. Các đề cương thường bao gồm phần lý thuyết tóm tắt và các dạng bài tập từ cơ bản đến nâng cao để học sinh có thể làm quen với dạng đề thi và rèn luyện kỹ năng giải bài tập.
VI. Lời Khuyên Học Tập
Học sinh nên chia nhỏ thời gian học để ôn tập từng phần của chương "Nguyên Tử". Hãy tập trung vào việc hiểu bản chất của các khái niệm thay vì học thuộc lòng, đồng thời thường xuyên luyện tập với các bài tập mẫu để nắm vững kiến thức.
Chúc các em học tập tốt và đạt kết quả cao trong các kỳ thi sắp tới!

.png)
1. Giới Thiệu Chung Về Chương Nguyên Tử
Chương nguyên tử là một phần quan trọng trong chương trình hóa học lớp 10, cung cấp những kiến thức cơ bản về cấu tạo và tính chất của nguyên tử - đơn vị nhỏ nhất tạo nên vật chất. Nội dung chương này giúp học sinh hiểu rõ hơn về các hạt cơ bản của nguyên tử như proton, neutron, electron và vai trò của chúng trong việc xác định tính chất hóa học của nguyên tử.
Chương này cũng giới thiệu về cấu hình electron, cách sắp xếp các electron trong các lớp và phân lớp, và mối liên hệ của cấu hình electron với vị trí của nguyên tố trong bảng tuần hoàn. Các kiến thức này là nền tảng để hiểu sâu hơn về các phản ứng hóa học và liên kết hóa học.
- Nguyên tử và các hạt cơ bản: Cung cấp kiến thức về proton, neutron, electron và các định nghĩa liên quan.
- Đồng vị: Giải thích khái niệm đồng vị, sự tồn tại của các đồng vị khác nhau và ứng dụng của chúng trong đời sống.
- Cấu hình electron: Giới thiệu về cách xác định cấu hình electron của các nguyên tố và ý nghĩa của chúng.
Thông qua việc học chương này, học sinh sẽ có nền tảng vững chắc để tiếp cận các kiến thức phức tạp hơn trong hóa học như liên kết hóa học, phản ứng hóa học, và đặc biệt là hiểu rõ hơn về bản chất của các nguyên tố trong bảng tuần hoàn.
2. Cấu Tạo Nguyên Tử
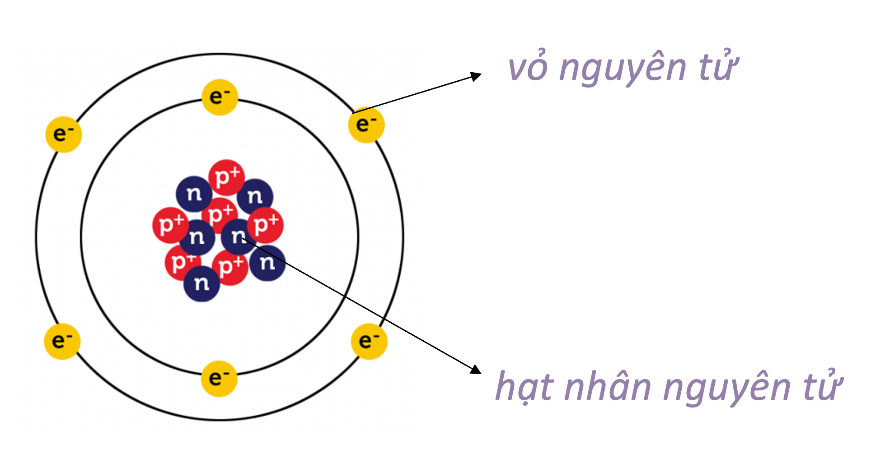
Nguyên tử là đơn vị cơ bản của vật chất, gồm ba loại hạt cơ bản: proton, neutron, và electron. Những hạt này tạo nên cấu trúc của nguyên tử và xác định tính chất hóa học của nguyên tố.
- Proton: Là hạt mang điện tích dương \((+1)\), nằm trong hạt nhân của nguyên tử. Số lượng proton trong hạt nhân xác định số hiệu nguyên tử và bản chất của nguyên tố. Ví dụ, nguyên tử hydro có 1 proton, trong khi nguyên tử oxy có 8 proton.
- Neutron: Là hạt không mang điện (điện tích bằng 0), cũng nằm trong hạt nhân của nguyên tử. Neutron có khối lượng gần bằng proton và cùng với proton, tạo nên khối lượng của nguyên tử. Số lượng neutron có thể thay đổi trong các đồng vị khác nhau của một nguyên tố.
- Electron: Là hạt mang điện tích âm \((-1)\), di chuyển xung quanh hạt nhân trong các lớp vỏ electron. Khối lượng của electron rất nhỏ so với proton và neutron, nhưng chúng đóng vai trò quan trọng trong việc xác định cấu hình electron và liên kết hóa học của nguyên tử.
Hạt nhân của nguyên tử chứa hầu hết khối lượng của nguyên tử và bao gồm các proton và neutron. Các electron di chuyển xung quanh hạt nhân trong các quỹ đạo xác định, tạo thành vỏ electron. Số lượng proton và neutron trong hạt nhân quyết định khối lượng nguyên tử và các tính chất khác như độ bền vững và khả năng phản ứng.
Cấu trúc của nguyên tử có thể được biểu diễn bằng nhiều mô hình khác nhau, từ mô hình Bohr đơn giản đến các mô hình lượng tử phức tạp hơn, mô tả sự phân bố xác suất của electron xung quanh hạt nhân.

3. Cấu Hình Electron của Nguyên Tử
Cấu hình electron của nguyên tử là cách sắp xếp các electron xung quanh hạt nhân trong các lớp vỏ và phân lớp khác nhau. Việc xác định cấu hình electron giúp hiểu rõ hơn về tính chất hóa học của nguyên tố, cũng như vị trí của nó trong bảng tuần hoàn.
Mỗi electron trong nguyên tử chiếm một vị trí trong các lớp vỏ năng lượng, được chia thành các phân lớp s, p, d, f. Các phân lớp này có thể chứa một số lượng electron nhất định, ví dụ:
- Phân lớp s: Tối đa 2 electron.
- Phân lớp p: Tối đa 6 electron.
- Phân lớp d: Tối đa 10 electron.
- Phân lớp f: Tối đa 14 electron.
Các electron sẽ điền vào các phân lớp theo thứ tự năng lượng từ thấp đến cao, tuân theo quy tắc Aufbau, nguyên lý Pauli, và quy tắc Hund:
- Quy tắc Aufbau: Electron sẽ lấp đầy các phân lớp có năng lượng thấp trước, sau đó mới đến các phân lớp có năng lượng cao hơn. Ví dụ, phân lớp 1s sẽ được điền đầy trước khi phân lớp 2s bắt đầu nhận electron.
- Nguyên lý Pauli: Mỗi orbital chỉ có thể chứa tối đa 2 electron với spin ngược nhau.
- Quy tắc Hund: Trong cùng một phân lớp, electron sẽ được phân bố vào các orbital trống trước khi ghép đôi với electron khác.
Ví dụ về cấu hình electron:
- Hydro (Z = 1): Cấu hình electron: \(1s^1\)
- Carbon (Z = 6): Cấu hình electron: \(1s^2 2s^2 2p^2\)
- Oxygen (Z = 8): Cấu hình electron: \(1s^2 2s^2 2p^4\)
Cấu hình electron không chỉ giúp xác định vị trí của nguyên tố trong bảng tuần hoàn mà còn giúp dự đoán tính chất hóa học, khả năng liên kết, và phản ứng của nguyên tố đó trong các phản ứng hóa học.

4. Bài Tập Về Cấu Tạo và Cấu Hình Electron
Để củng cố kiến thức về cấu tạo và cấu hình electron của nguyên tử, các bài tập dưới đây sẽ giúp bạn rèn luyện kỹ năng tính toán và hiểu rõ hơn về nguyên tắc sắp xếp electron trong nguyên tử.
Bài Tập 1: Xác định cấu hình electron
Viết cấu hình electron cho các nguyên tố sau:
- Nguyên tố Natri (Z = 11)
- Nguyên tố Clo (Z = 17)
- Nguyên tố Sắt (Z = 26)
Bài Tập 2: Xác định số electron độc thân
Với các nguyên tố sau, hãy xác định số electron độc thân trong nguyên tử:
- Nguyên tố Carbon (Z = 6)
- Nguyên tố Nitơ (Z = 7)
- Nguyên tố Lưu huỳnh (Z = 16)
Bài Tập 3: Phân bố electron trong phân lớp
Hoàn thành bảng sau về số electron trong các phân lớp của các nguyên tố được cho:
| Nguyên Tố | Số Electron | Phân Lớp s | Phân Lớp p | Phân Lớp d | Phân Lớp f |
|---|---|---|---|---|---|
| Photpho (Z = 15) | 15 | ... | ... | ... | ... |
| Canxi (Z = 20) | 20 | ... | ... | ... | ... |
| Kẽm (Z = 30) | 30 | ... | ... | ... | ... |
Bài Tập 4: Áp dụng quy tắc Hund và Pauli
Vẽ sơ đồ cấu hình electron cho các nguyên tố sau và chỉ ra sự phân bố electron theo quy tắc Hund và nguyên lý Pauli:
- Nguyên tố Oxy (Z = 8)
- Nguyên tố Ne (Z = 10)
- Nguyên tố Magie (Z = 12)
Những bài tập trên sẽ giúp bạn nắm vững hơn về cách sắp xếp electron trong nguyên tử, từ đó hiểu rõ tính chất hóa học của các nguyên tố.

5. Các Nguyên Lý và Quy Tắc Cần Nhớ
Trong chương nguyên tử, việc hiểu và ghi nhớ các nguyên lý và quy tắc cơ bản là rất quan trọng để giải quyết các bài tập và áp dụng vào thực tế. Dưới đây là các nguyên lý và quy tắc bạn cần nắm vững:
1. Nguyên lý vững bền (Aufbau)
Theo nguyên lý vững bền, các electron sẽ điền vào các obitan từ mức năng lượng thấp nhất đến cao hơn. Mức năng lượng của các obitan được xác định bởi tổng số thứ tự của chúng, gọi là quy tắc (n + l). Nếu hai obitan có giá trị (n + l) bằng nhau, electron sẽ điền vào obitan có n nhỏ hơn trước.
2. Quy tắc Hund
Quy tắc Hund phát biểu rằng, trong một phân lớp, electron sẽ điền vào các obitan trống trước khi bắt cặp. Điều này giúp giảm thiểu sự đẩy giữa các electron và tạo ra cấu hình electron ổn định nhất có thể.
3. Nguyên lý loại trừ Pauli
Nguyên lý loại trừ Pauli nêu rõ rằng, trong một nguyên tử, không có hai electron nào có cùng bốn số lượng tử. Mỗi obitan chỉ chứa tối đa hai electron và chúng phải có spin ngược chiều nhau.
4. Quy tắc Heisenberg
Nguyên lý bất định của Heisenberg phát biểu rằng, không thể đồng thời xác định chính xác vị trí và động lượng của một hạt. Điều này có nghĩa rằng, càng đo chính xác vị trí của electron, chúng ta càng ít biết về động lượng của nó, và ngược lại.
5. Nguyên lý về mức năng lượng tối thiểu
Electron trong một nguyên tử luôn có xu hướng chiếm vị trí có mức năng lượng thấp nhất có thể. Điều này giải thích tại sao các electron đầu tiên luôn điền vào các obitan có mức năng lượng thấp nhất trước khi chuyển sang các obitan cao hơn.
Việc nắm vững các nguyên lý và quy tắc này là bước đầu quan trọng để hiểu sâu hơn về cấu trúc nguyên tử và các tính chất hóa học liên quan.
XEM THÊM:
6. Đề Cương Ôn Tập và Luyện Tập
Chương nguyên tử là một phần quan trọng trong Hóa học lớp 10, yêu cầu học sinh nắm vững kiến thức lý thuyết cũng như kỹ năng giải bài tập. Dưới đây là các nội dung đề cương và bài tập luyện tập để chuẩn bị cho kỳ thi.
6.1 Tóm Tắt Lý Thuyết Chương Nguyên Tử
- Cấu tạo nguyên tử: Nguyên tử gồm có ba hạt cơ bản: proton (mang điện dương), neutron (không mang điện) và electron (mang điện âm).
- Số khối (A) và số hiệu nguyên tử (Z): Số khối là tổng số proton và neutron trong hạt nhân. Số hiệu nguyên tử là số proton trong nguyên tử, giúp xác định loại nguyên tố.
- Đồng vị: Là các nguyên tử của cùng một nguyên tố có cùng số proton nhưng khác nhau về số neutron.
- Cấu hình electron: Electron trong nguyên tử được phân bố theo các lớp và phân lớp, tuân theo nguyên lý Pauli, nguyên lý Aufbau và quy tắc Hund.
6.2 Các Đề Thi Mẫu Học Kỳ
Dưới đây là một số dạng câu hỏi thường gặp trong các kỳ thi liên quan đến chương nguyên tử:
- Xác định số proton, neutron và electron: Cho biết số khối và số hiệu nguyên tử, tính số neutron theo công thức: \[ \text{Số neutron} = A - Z \]
- Cấu hình electron: Viết cấu hình electron cho các nguyên tử theo thứ tự lớp và phân lớp (s, p, d, f).
- Bài tập đồng vị: Tính khối lượng nguyên tử trung bình của một nguyên tố có nhiều đồng vị theo công thức: \[ \text{Khối lượng trung bình} = \frac{\sum (\text{khối lượng đồng vị} \times \text{% đồng vị})}{100} \]
- Câu hỏi trắc nghiệm: Lựa chọn các định nghĩa đúng liên quan đến nguyên tử, cấu hình electron và đồng vị.
6.3 Bài Tập Tự Luyện
Học sinh nên tự luyện các bài tập sau đây để củng cố kiến thức:
- Viết cấu hình electron cho các nguyên tố từ Z = 1 đến Z = 30.
- Giải các bài toán xác định số proton, neutron và electron từ số khối và số hiệu nguyên tử.
- Giải các bài tập tính nguyên tử khối trung bình dựa trên đồng vị.
- Thực hành các câu hỏi trắc nghiệm về cấu tạo nguyên tử, đồng vị và số khối.
Việc ôn tập đầy đủ và thực hành các bài tập là chìa khóa để đạt kết quả cao trong các kỳ thi. Hãy chia nhỏ nội dung học tập và ôn luyện thường xuyên để nắm vững kiến thức.

7. Lời Khuyên Học Tập Hiệu Quả
Để ôn tập chương nguyên tử và các kiến thức Hóa Học lớp 10 một cách hiệu quả, bạn cần áp dụng những phương pháp học tập khoa học và kỷ luật. Dưới đây là một số lời khuyên hữu ích giúp bạn cải thiện việc học của mình:
7.1 Cách Chia Thời Gian Ôn Tập
Chia thời gian ôn tập hợp lý sẽ giúp bạn duy trì sự tập trung và không bị quá tải. Hãy áp dụng kỹ thuật Pomodoro: học tập trong 25 phút, sau đó nghỉ 5 phút. Mỗi 4 phiên học nên có một quãng nghỉ dài hơn, từ 15-30 phút, để não bộ thư giãn và xử lý thông tin.
- Học liên tục quá lâu có thể dẫn đến mất tập trung. Hãy giữ lịch trình ôn tập hàng ngày và luôn tuân thủ.
- Sắp xếp ôn tập các phần kiến thức khó vào thời gian đầu của mỗi phiên học, khi não bộ còn hoạt động tốt nhất.
7.2 Phương Pháp Ghi Nhớ Lý Thuyết
Sử dụng các phương pháp ghi nhớ như hệ thống sơ đồ tư duy (mind map) hoặc các ghi chú tóm tắt giúp bạn nắm bắt các khái niệm phức tạp một cách dễ dàng hơn. Đặc biệt với chương nguyên tử, bạn có thể tạo sơ đồ mô tả cấu tạo nguyên tử, electron, proton và neutron.
- Liên kết thông tin mới với kiến thức đã biết để giúp việc ghi nhớ dễ dàng hơn.
- Đọc lại các ghi chú ngay sau khi kết thúc buổi học để củng cố trí nhớ dài hạn.
7.3 Luyện Tập Qua Bài Tập Thực Hành
Luyện tập là chìa khóa để nắm vững kiến thức. Hãy thực hành bài tập liên quan đến cấu tạo nguyên tử, cấu hình electron, và các bài tập đồng vị thường xuyên. Điều này giúp bạn củng cố hiểu biết về lý thuyết và nâng cao kỹ năng giải quyết vấn đề.
- Bắt đầu với các bài tập cơ bản để ôn lại lý thuyết.
- Tiếp tục với các bài tập nâng cao và phức tạp hơn để rèn luyện tư duy phản biện.
- Không quên kiểm tra kết quả của mình và rút ra bài học từ những sai lầm.
Với những phương pháp và kỹ thuật học tập này, bạn sẽ ôn tập chương nguyên tử một cách hiệu quả và đạt kết quả tốt trong các kỳ thi.