Chủ đề điện tích hạt nhân của nguyên tử là gì: Điện tích hạt nhân của nguyên tử là yếu tố quan trọng giúp xác định tính chất hóa học và vật lý của các nguyên tố. Bài viết này sẽ giúp bạn hiểu rõ hơn về điện tích hạt nhân, cách tính toán và những ứng dụng của nó trong khoa học và công nghệ.
Mục lục
- Điện Tích Hạt Nhân Của Nguyên Tử
- 1. Khái Niệm Điện Tích Hạt Nhân
- 2. Cấu Tạo Hạt Nhân Nguyên Tử
- 3. Công Thức Tính Điện Tích Hạt Nhân
- 4. Ảnh Hưởng của Điện Tích Hạt Nhân
- 5. Điện Tích Hạt Nhân và Vị Trí Nguyên Tố trong Bảng Tuần Hoàn
- 6. Ví Dụ Điện Tích Hạt Nhân Của Một Số Nguyên Tố
- 7. Ứng Dụng Thực Tiễn của Điện Tích Hạt Nhân
Điện Tích Hạt Nhân Của Nguyên Tử
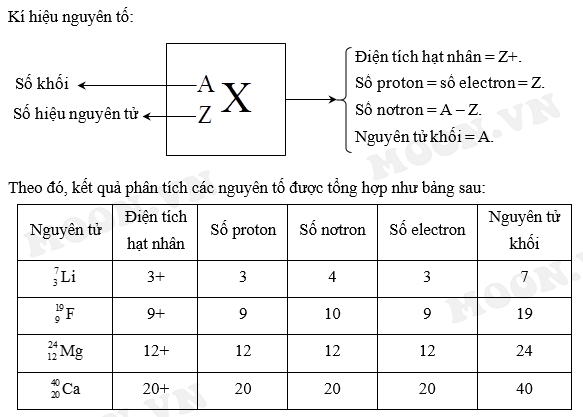
Điện tích hạt nhân của nguyên tử là tổng điện tích dương do các proton trong hạt nhân tạo nên. Điện tích này đóng vai trò quyết định đối với cấu trúc và tính chất hóa học của nguyên tử, cũng như xác định vị trí của nguyên tố trong bảng tuần hoàn.
Khái Niệm Điện Tích Hạt Nhân
Điện tích hạt nhân được xác định bởi số lượng proton trong hạt nhân và được ký hiệu là Z. Mỗi proton mang một điện tích dương có giá trị bằng điện tích của electron nhưng trái dấu. Công thức tính điện tích hạt nhân là:
\[
Q = Z \cdot e
\]
Trong đó:
- Q là điện tích hạt nhân.
- Z là số proton trong hạt nhân.
- e là điện tích của một proton, khoảng \(1.602 \times 10^{-19}\) coulomb.
Tầm Quan Trọng Của Điện Tích Hạt Nhân
- Xác định vị trí trong bảng tuần hoàn: Giá trị của Z giúp xác định vị trí của nguyên tố trong bảng tuần hoàn, từ đó xác định tính chất hóa học và vật lý của nó.
- Ảnh hưởng đến cấu trúc electron: Số proton trong hạt nhân quyết định số electron trong các lớp vỏ electron, ảnh hưởng đến kích thước và cấu trúc của nguyên tử.
- Tương tác hóa học: Điện tích hạt nhân ảnh hưởng đến cách mà nguyên tử tương tác với các nguyên tử khác trong các phản ứng hóa học.
Cấu Tạo Của Hạt Nhân Nguyên Tử
Hạt nhân nguyên tử nằm ở trung tâm của nguyên tử và chứa phần lớn khối lượng của nguyên tử. Nó được cấu tạo từ hai loại hạt cơ bản là proton và neutron.
| Hạt | Điện tích | Khối lượng (kg) |
|---|---|---|
| Proton | +1 | 1.6726 x 10-27 |
| Neutron | 0 | 1.6750 x 10-27 |
Công Thức Và Ví Dụ Tính Điện Tích Hạt Nhân
Để tính điện tích hạt nhân của một nguyên tử, chúng ta sử dụng công thức:
\[
Q = Z \cdot e
\]
Ví dụ, nếu nguyên tử oxy có 8 proton, điện tích hạt nhân của oxy sẽ là:
\[
Q = 8 \cdot 1.602 \times 10^{-19} = 1.282 \times 10^{-18} \, \text{coulomb}
\]
Ví Dụ Về Điện Tích Hạt Nhân Của Một Số Nguyên Tố
| Nguyên Tố | Ký Hiệu | Số Proton (Z) | Điện Tích Hạt Nhân (Coulomb) |
|---|---|---|---|
| Hydro | H | 1 | 1.602 x 10-19 |
| Heli | He | 2 | 3.204 x 10-19 |
| Carbon | C | 6 | 9.612 x 10-19 |
| Oxy | O | 8 | 1.282 x 10-18 |
Kết Luận
Điện tích hạt nhân là yếu tố quan trọng quyết định cấu trúc và tính chất của nguyên tử. Việc hiểu rõ về điện tích hạt nhân giúp giải thích các hiện tượng tự nhiên và các ứng dụng trong khoa học và công nghệ.

.png)
1. Khái Niệm Điện Tích Hạt Nhân
Điện tích hạt nhân là tổng số điện tích dương được tạo ra bởi các proton trong hạt nhân của nguyên tử. Điện tích này đóng vai trò quan trọng trong việc xác định tính chất hóa học và vật lý của nguyên tố cũng như ảnh hưởng đến sự sắp xếp của các electron trong vỏ nguyên tử.
Công thức tính điện tích hạt nhân được biểu diễn như sau:
\[
Q = Z \cdot e
\]
- Q: Điện tích hạt nhân của nguyên tử.
- Z: Số proton trong hạt nhân, còn gọi là số nguyên tử.
- e: Điện tích của một proton, khoảng \( 1.602 \times 10^{-19} \) coulomb.
Trong một nguyên tử, số proton bằng số electron, vì vậy tổng điện tích của nguyên tử là trung hòa. Tuy nhiên, hạt nhân chứa các proton mang điện tích dương và neutron không mang điện tích. Số lượng proton (tức Z) quyết định danh tính của nguyên tố hóa học.
Ví dụ:
Nguyên tử hydro có một proton trong hạt nhân, do đó điện tích hạt nhân của nó là:
\[
Q = 1 \cdot 1.602 \times 10^{-19} \, \text{coulomb} = 1.602 \times 10^{-19} \, \text{coulomb}
\]
Nguyên tử oxy có 8 proton trong hạt nhân, do đó điện tích hạt nhân của nó là:
\[
Q = 8 \cdot 1.602 \times 10^{-19} \, \text{coulomb} = 1.282 \times 10^{-18} \, \text{coulomb}
\]
Điện tích hạt nhân là yếu tố quyết định nhiều tính chất quan trọng của nguyên tử như lực hút giữa hạt nhân và các electron, năng lượng ion hóa và độ âm điện. Nó đóng vai trò trung tâm trong việc hình thành cấu trúc nguyên tử và các phản ứng hóa học.
2. Cấu Tạo Hạt Nhân Nguyên Tử
Hạt nhân nguyên tử là phần trung tâm của nguyên tử, nơi tập trung gần như toàn bộ khối lượng của nguyên tử. Hạt nhân được cấu tạo từ hai loại hạt cơ bản: proton và neutron. Cả proton và neutron đều được gọi chung là nucleon.
Các thành phần chính của hạt nhân nguyên tử:
- Proton: Là hạt mang điện tích dương (+1). Số proton trong hạt nhân quyết định số nguyên tử (Z) và đặc trưng của nguyên tố hóa học. Ví dụ, nguyên tử hydro có một proton, trong khi nguyên tử oxy có tám proton.
- Neutron: Là hạt không mang điện tích. Chúng giúp duy trì sự ổn định của hạt nhân bằng cách giảm lực đẩy điện tích giữa các proton. Số neutron có thể khác nhau trong các nguyên tử của cùng một nguyên tố, tạo ra các đồng vị.
Mô hình hạt nhân nguyên tử:
Trong hạt nhân, các proton và neutron được giữ chặt với nhau bởi lực hạt nhân mạnh, một lực tương tác mạnh hơn rất nhiều so với lực đẩy điện giữa các proton. Điều này giúp duy trì sự ổn định của hạt nhân mặc dù có sự đẩy giữa các proton.
Công thức số khối của hạt nhân:
Số khối của hạt nhân (A) được xác định bởi tổng số proton và neutron trong hạt nhân:
\[
A = Z + N
\]
- A: Số khối (tổng số proton và neutron).
- Z: Số proton (số nguyên tử).
- N: Số neutron.
Bảng mô tả các đặc điểm chính của proton và neutron:
| Hạt | Điện tích | Khối lượng (kg) |
|---|---|---|
| Proton | +1 | 1.6726 × 10-27 |
| Neutron | 0 | 1.6750 × 10-27 |
Hạt nhân nguyên tử có kích thước rất nhỏ, khoảng vài femtomet (1 fm = \( 10^{-15} \) mét). Mặc dù nhỏ bé, hạt nhân chứa gần như toàn bộ khối lượng của nguyên tử, trong khi các electron xung quanh gần như không có khối lượng đáng kể so với hạt nhân.
Việc nghiên cứu cấu tạo hạt nhân nguyên tử giúp chúng ta hiểu rõ hơn về bản chất của các phản ứng hạt nhân, đồng vị, và những ứng dụng quan trọng của chúng trong y học, năng lượng và các lĩnh vực khoa học khác.

3. Công Thức Tính Điện Tích Hạt Nhân
Điện tích hạt nhân là tổng số điện tích dương của các proton trong hạt nhân của nguyên tử. Để tính điện tích hạt nhân, ta sử dụng công thức đơn giản dựa trên số lượng proton và điện tích của mỗi proton.
Công Thức Tính:
Công thức tính điện tích hạt nhân được biểu diễn như sau:
\[
Q = Z \cdot e
\]
- Q: Điện tích hạt nhân (tính bằng coulomb).
- Z: Số proton trong hạt nhân (số nguyên tử của nguyên tố).
- e: Điện tích của một proton, có giá trị xấp xỉ \(1.602 \times 10^{-19}\) coulomb.
Ví dụ minh họa:
- Nguyên tử Hydro: Nguyên tử hydro có 1 proton trong hạt nhân, nên điện tích hạt nhân của nó là:
\[
Q = 1 \cdot 1.602 \times 10^{-19} \, \text{coulomb} = 1.602 \times 10^{-19} \, \text{coulomb}
\] - Nguyên tử Oxy: Nguyên tử oxy có 8 proton trong hạt nhân, nên điện tích hạt nhân của nó là:
\[
Q = 8 \cdot 1.602 \times 10^{-19} \, \text{coulomb} = 1.282 \times 10^{-18} \, \text{coulomb}
\]
Bước tính toán:
- Xác định số proton trong hạt nhân (Z) từ số nguyên tử của nguyên tố.
- Sử dụng giá trị điện tích của một proton (\( e = 1.602 \times 10^{-19} \, \text{coulomb} \)).
- Áp dụng công thức \( Q = Z \cdot e \) để tính điện tích hạt nhân.
Bảng điện tích hạt nhân của một số nguyên tố:
| Nguyên Tố | Số Proton (Z) | Điện Tích Hạt Nhân (Coulomb) |
|---|---|---|
| Hydro (H) | 1 | 1.602 x 10-19 |
| Helium (He) | 2 | 3.204 x 10-19 |
| Carbon (C) | 6 | 9.612 x 10-19 |
| Oxy (O) | 8 | 1.282 x 10-18 |
Công thức tính điện tích hạt nhân rất hữu ích trong việc xác định đặc điểm vật lý và hóa học của nguyên tử, từ đó cung cấp hiểu biết sâu sắc hơn về các hiện tượng vi mô trong tự nhiên.
4. Ảnh Hưởng của Điện Tích Hạt Nhân
Điện tích hạt nhân đóng vai trò quan trọng trong việc định hình các tính chất hóa học và vật lý của nguyên tử. Nó ảnh hưởng trực tiếp đến lực hút giữa hạt nhân và các electron, từ đó tác động đến cấu trúc nguyên tử và các phản ứng hóa học. Dưới đây là một số ảnh hưởng chính của điện tích hạt nhân:
4.1 Lực Hút Giữa Hạt Nhân và Electron
Điện tích hạt nhân tạo ra một lực hút tĩnh điện giữa hạt nhân (mang điện tích dương) và các electron (mang điện tích âm) quay quanh nó. Lực hút này quyết định sự sắp xếp của các electron trong các lớp vỏ nguyên tử. Càng nhiều proton trong hạt nhân, lực hút càng mạnh, làm các electron bị hút gần hơn về phía hạt nhân.
4.2 Ảnh Hưởng Đến Bán Kính Nguyên Tử
Điện tích hạt nhân có ảnh hưởng lớn đến kích thước của nguyên tử. Khi số lượng proton tăng lên, lực hút giữa hạt nhân và electron mạnh hơn, kéo các electron lại gần hạt nhân hơn, từ đó làm giảm bán kính nguyên tử. Ngược lại, nếu điện tích hạt nhân nhỏ, bán kính nguyên tử sẽ lớn hơn do lực hút yếu hơn.
4.3 Điện Tích Hạt Nhân và Năng Lượng Ion Hóa
Năng lượng ion hóa là năng lượng cần thiết để tách một electron ra khỏi nguyên tử. Khi điện tích hạt nhân tăng lên, lực hút giữa hạt nhân và electron mạnh hơn, do đó cần nhiều năng lượng hơn để ion hóa nguyên tử. Ví dụ, nguyên tử có điện tích hạt nhân lớn như neon sẽ có năng lượng ion hóa cao hơn so với các nguyên tử có điện tích nhỏ hơn như natri.
4.4 Độ Âm Điện và Điện Tích Hạt Nhân
Độ âm điện là khả năng của nguyên tử để hút electron trong một liên kết hóa học. Điện tích hạt nhân càng lớn, độ âm điện càng cao do lực hút mạnh giữa hạt nhân và các electron liên kết. Điều này giải thích tại sao các nguyên tố như fluor có độ âm điện cao, bởi vì chúng có điện tích hạt nhân lớn và dễ dàng hút các electron từ các nguyên tử khác.
4.5 Ảnh Hưởng Đến Cấu Trúc Bảng Tuần Hoàn
Trong bảng tuần hoàn, điện tích hạt nhân tăng dần từ trái sang phải và từ trên xuống dưới. Điều này dẫn đến sự thay đổi tính chất của các nguyên tố, chẳng hạn như độ âm điện, năng lượng ion hóa và bán kính nguyên tử. Các nguyên tố thuộc cùng một nhóm có số proton tăng dần theo chiều dọc, nhưng số lớp electron cũng tăng, làm cho lực hút giữa hạt nhân và electron ngoài cùng giảm đi.
Bảng Minh Họa Ảnh Hưởng của Điện Tích Hạt Nhân
| Nguyên Tố | Điện Tích Hạt Nhân (số proton) | Năng Lượng Ion Hóa (kJ/mol) | Bán Kính Nguyên Tử (pm) |
|---|---|---|---|
| Hydro (H) | 1 | 1312 | 53 |
| Helium (He) | 2 | 2372 | 31 |
| Lithium (Li) | 3 | 520 | 167 |
| Oxy (O) | 8 | 1314 | 60 |
Điện tích hạt nhân có ảnh hưởng to lớn đến các tính chất cơ bản của nguyên tử và từ đó quyết định tính chất hóa học của các nguyên tố. Hiểu rõ về ảnh hưởng của điện tích hạt nhân giúp chúng ta có cái nhìn sâu hơn về sự sắp xếp của các nguyên tố trong bảng tuần hoàn và các hiện tượng hóa học liên quan.

5. Điện Tích Hạt Nhân và Vị Trí Nguyên Tố trong Bảng Tuần Hoàn
Điện tích hạt nhân là yếu tố then chốt ảnh hưởng đến vị trí của các nguyên tố trong bảng tuần hoàn. Vị trí của một nguyên tố được xác định bởi số proton trong hạt nhân (điện tích hạt nhân), còn được gọi là số nguyên tử của nguyên tố đó. Bảng tuần hoàn được sắp xếp dựa trên sự tăng dần của điện tích hạt nhân từ trái sang phải và từ trên xuống dưới. Điều này ảnh hưởng lớn đến các tính chất hóa học của các nguyên tố.
5.1 Điện Tích Hạt Nhân và Số Nguyên Tử
Mỗi nguyên tố trong bảng tuần hoàn có một số nguyên tử duy nhất, đại diện cho số proton trong hạt nhân. Ví dụ:
- Hydro có số nguyên tử là 1, nghĩa là nó có 1 proton trong hạt nhân.
- Cacbon có số nguyên tử là 6, nghĩa là nó có 6 proton trong hạt nhân.
- Oxy có số nguyên tử là 8, nghĩa là nó có 8 proton trong hạt nhân.
Vì vậy, vị trí của một nguyên tố trong bảng tuần hoàn có liên hệ trực tiếp với điện tích hạt nhân của nó.
5.2 Xu Hướng Thay Đổi trong Bảng Tuần Hoàn
Điện tích hạt nhân tăng dần khi ta di chuyển từ trái sang phải trong cùng một chu kỳ của bảng tuần hoàn. Điều này gây ra một số xu hướng thay đổi tính chất hóa học của các nguyên tố:
- Bán Kính Nguyên Tử: Khi điện tích hạt nhân tăng, lực hút giữa hạt nhân và các electron ngoài cùng mạnh hơn, làm giảm bán kính nguyên tử.
- Năng Lượng Ion Hóa: Điện tích hạt nhân lớn hơn làm tăng năng lượng cần thiết để tách một electron khỏi nguyên tử, do đó năng lượng ion hóa tăng dần từ trái sang phải.
- Độ Âm Điện: Độ âm điện cũng tăng dần từ trái sang phải trong bảng tuần hoàn do điện tích hạt nhân mạnh hơn, kéo các electron gần hạt nhân hơn.
5.3 Các Nhóm và Chu Kỳ trong Bảng Tuần Hoàn
- Nhóm: Các nguyên tố trong cùng một nhóm (cột dọc) có cùng số electron ở lớp vỏ ngoài cùng, nhưng điện tích hạt nhân tăng dần từ trên xuống dưới. Điều này dẫn đến các nguyên tố trong cùng một nhóm có tính chất hóa học tương tự nhau, nhưng độ mạnh của các tính chất này có thể thay đổi do sự gia tăng điện tích hạt nhân.
- Chu Kỳ: Trong mỗi chu kỳ (hàng ngang), các nguyên tố có số lớp electron giống nhau, nhưng điện tích hạt nhân tăng dần từ trái sang phải, làm cho các tính chất như bán kính nguyên tử và độ âm điện thay đổi có hệ thống.
Bảng Ví Dụ về Điện Tích Hạt Nhân và Vị Trí Nguyên Tố
| Nguyên Tố | Số Nguyên Tử | Điện Tích Hạt Nhân (Số Proton) | Vị Trí trong Bảng Tuần Hoàn |
|---|---|---|---|
| Hydro (H) | 1 | 1 | Chu kỳ 1, Nhóm 1 |
| Helium (He) | 2 | 2 | Chu kỳ 1, Nhóm 18 |
| Lithium (Li) | 3 | 3 | Chu kỳ 2, Nhóm 1 |
| Neon (Ne) | 10 | 10 | Chu kỳ 2, Nhóm 18 |
5.4 Điện Tích Hạt Nhân và Tính Chất Hóa Học
Điện tích hạt nhân ảnh hưởng trực tiếp đến tính chất hóa học của các nguyên tố. Các nguyên tố ở vị trí gần nhau trong bảng tuần hoàn có tính chất tương đồng nhờ sự tương đồng về điện tích hạt nhân. Ví dụ, các nguyên tố nhóm 1 như natri (Na) và kali (K) đều có tính chất hóa học tương tự vì chúng có số proton gần nhau và cùng có một electron ở lớp vỏ ngoài cùng.
Kết luận, điện tích hạt nhân không chỉ xác định vị trí của nguyên tố trong bảng tuần hoàn mà còn ảnh hưởng đến các tính chất hóa học và vật lý của nguyên tố đó, từ bán kính nguyên tử, năng lượng ion hóa đến độ âm điện.
XEM THÊM:
6. Ví Dụ Điện Tích Hạt Nhân Của Một Số Nguyên Tố
Điện tích hạt nhân của một nguyên tố được xác định bởi số lượng proton trong hạt nhân của nó. Dưới đây là một số ví dụ về điện tích hạt nhân của các nguyên tố phổ biến. Những ví dụ này giúp chúng ta hiểu rõ hơn về cách điện tích hạt nhân ảnh hưởng đến tính chất hóa học và vật lý của nguyên tố.
6.1 Hydro (H)
- Số nguyên tử: 1
- Điện tích hạt nhân: +1 (1 proton)
- Đặc điểm: Là nguyên tố nhẹ nhất trong bảng tuần hoàn, với điện tích hạt nhân nhỏ nhất.
6.2 Helium (He)
- Số nguyên tử: 2
- Điện tích hạt nhân: +2 (2 proton)
- Đặc điểm: Là nguyên tố khí trơ, có cấu trúc ổn định với 2 electron trong lớp vỏ ngoài cùng.
6.3 Carbon (C)
- Số nguyên tử: 6
- Điện tích hạt nhân: +6 (6 proton)
- Đặc điểm: Carbon là nguyên tố chính trong cấu trúc hữu cơ và có khả năng tạo ra nhiều hợp chất hóa học phức tạp.
6.4 Oxy (O)
- Số nguyên tử: 8
- Điện tích hạt nhân: +8 (8 proton)
- Đặc điểm: Oxy là nguyên tố rất phổ biến trên Trái Đất và cần thiết cho sự sống, đặc biệt trong quá trình hô hấp của sinh vật.
6.5 Neon (Ne)
- Số nguyên tử: 10
- Điện tích hạt nhân: +10 (10 proton)
- Đặc điểm: Là một khí trơ, không phản ứng với các nguyên tố khác, được sử dụng phổ biến trong các biển quảng cáo phát sáng.
6.6 Sắt (Fe)
- Số nguyên tử: 26
- Điện tích hạt nhân: +26 (26 proton)
- Đặc điểm: Là kim loại phổ biến, có vai trò quan trọng trong ngành công nghiệp và sinh học (ví dụ trong hemoglobin).
Bảng Ví Dụ Điện Tích Hạt Nhân Của Một Số Nguyên Tố
| Nguyên Tố | Số Nguyên Tử | Điện Tích Hạt Nhân (Số Proton) | Tính Chất |
|---|---|---|---|
| Hydro (H) | 1 | +1 | Nguyên tố nhẹ nhất |
| Helium (He) | 2 | +2 | Khí trơ, không phản ứng |
| Carbon (C) | 6 | +6 | Thành phần cơ bản của sự sống |
| Oxy (O) | 8 | +8 | Quan trọng cho hô hấp |
| Neon (Ne) | 10 | +10 | Khí trơ, dùng trong biển quảng cáo |
| Sắt (Fe) | 26 | +26 | Kim loại, ứng dụng rộng rãi |
Những ví dụ trên giúp chúng ta thấy rõ mối quan hệ giữa số proton và điện tích hạt nhân của các nguyên tố khác nhau. Điện tích hạt nhân không chỉ quyết định vị trí của nguyên tố trong bảng tuần hoàn mà còn ảnh hưởng trực tiếp đến tính chất hóa học và vật lý của chúng.

7. Ứng Dụng Thực Tiễn của Điện Tích Hạt Nhân
Điện tích hạt nhân của nguyên tử có nhiều ứng dụng thực tiễn quan trọng trong các lĩnh vực như y học, công nghiệp, và nghiên cứu khoa học. Các ứng dụng này không chỉ giúp con người hiểu rõ hơn về cấu trúc nguyên tử mà còn có vai trò lớn trong nhiều công nghệ hiện đại.
7.1 Ứng Dụng trong Nghiên Cứu Vật Lý Hạt Nhân
Nghiên cứu điện tích hạt nhân là nền tảng để hiểu sâu hơn về các tương tác trong vật lý hạt nhân. Các nghiên cứu này giúp xác định cấu trúc hạt nhân và khám phá các lực tương tác giữa các hạt proton và neutron, từ đó mở ra nhiều hướng phát triển cho vật lý lý thuyết và ứng dụng.
7.2 Ứng Dụng trong Y Khoa
Các kỹ thuật y khoa như xạ trị và chụp cắt lớp (CT) dựa vào các đồng vị phóng xạ từ các hạt nhân nguyên tử để phát hiện và điều trị bệnh. Những ứng dụng này giúp cải thiện độ chính xác trong chẩn đoán và tăng hiệu quả trong điều trị các bệnh nghiêm trọng.
7.3 Ứng Dụng trong Công Nghiệp
Trong công nghiệp, điện tích hạt nhân đóng vai trò quan trọng trong các nhà máy điện hạt nhân, cung cấp nguồn năng lượng khổng lồ và hiệu quả. Ngoài ra, việc nghiên cứu và kiểm soát điện tích hạt nhân còn được sử dụng trong sản xuất các vật liệu đặc biệt và xử lý chất thải.