Chủ đề điện tích hạt nhân và số khối: Điện tích hạt nhân và số khối là hai khái niệm quan trọng trong hóa học, đóng vai trò cơ bản trong việc hiểu cấu trúc nguyên tử và tính chất của các nguyên tố. Bài viết này sẽ giúp bạn khám phá chi tiết về điện tích hạt nhân, số khối và ứng dụng của chúng trong thực tế một cách dễ hiểu và sâu sắc nhất.
Mục lục
Điện tích hạt nhân và số khối
Điện tích hạt nhân và số khối là hai khái niệm cơ bản trong hóa học, liên quan đến cấu trúc của nguyên tử. Chúng là những chỉ số quan trọng để phân biệt các nguyên tố hóa học với nhau và được sử dụng rộng rãi trong nhiều ứng dụng khoa học và công nghệ.
1. Điện tích hạt nhân
Điện tích hạt nhân của một nguyên tử được ký hiệu là Z và được xác định bởi số proton có trong hạt nhân của nguyên tử đó. Điện tích hạt nhân thể hiện tính chất cơ bản của nguyên tử vì nó quyết định số electron trong lớp vỏ, từ đó ảnh hưởng đến cấu trúc hóa học và lý tính của nguyên tố.
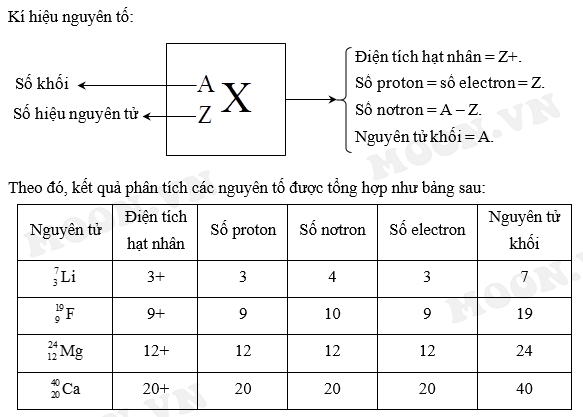
- Điện tích hạt nhân \( Z = P \), trong đó P là số proton trong hạt nhân.
- Ví dụ: Nguyên tử carbon (C) có \( Z = 6 \), tức là có 6 proton trong hạt nhân.
2. Số khối
Số khối của một nguyên tử, ký hiệu là A, là tổng số proton và neutron trong hạt nhân của nguyên tử đó. Đây là chỉ số đại diện cho khối lượng nguyên tử tính theo đơn vị khối lượng nguyên tử (amu).
Công thức tính số khối:
\[
A = Z + N
\]
- Trong đó: A là số khối, Z là số proton, N là số neutron.
- Ví dụ: Nguyên tử nhôm (Al) có 13 proton và 14 neutron, do đó số khối \( A = 13 + 14 = 27 \).
3. Đồng vị
Các nguyên tử của cùng một nguyên tố có cùng số proton nhưng khác số neutron được gọi là các đồng vị. Do đó, các đồng vị có cùng điện tích hạt nhân nhưng có số khối khác nhau.
- Ví dụ: Nguyên tố carbon có hai đồng vị phổ biến là \( ^{12}C \) và \( ^{14}C \), với số khối lần lượt là 12 và 14.
4. Ứng dụng của điện tích hạt nhân và số khối
Điện tích hạt nhân và số khối có vai trò quan trọng trong nhiều lĩnh vực như:
- Giải thích các hiện tượng hóa học cơ bản.
- Xác định tính chất và cấu trúc của các nguyên tố và hợp chất.
- Sử dụng trong nghiên cứu khoa học và công nghệ, đặc biệt trong y học và vật lý hạt nhân.
5. Các bài tập và ví dụ minh họa
Để hiểu rõ hơn về các khái niệm này, bạn có thể tham khảo một số bài tập và ví dụ minh họa:
- Xác định điện tích hạt nhân và số khối của một nguyên tử bất kỳ dựa trên các thông số cho trước.
- Tính nguyên tử khối trung bình của một nguyên tố dựa trên các đồng vị của nó.
- Phân tích cấu trúc của nguyên tử và vai trò của các thành phần trong hạt nhân.
| Nguyên tố | Số proton (Z) | Số neutron (N) | Số khối (A) |
|---|---|---|---|
| Carbon (C) | 6 | 6 | 12 |
| Nhôm (Al) | 13 | 14 | 27 |
| Uranium (U) | 92 | 146 | 238 |
Bài viết trên đây cung cấp thông tin cơ bản về điện tích hạt nhân và số khối, giúp bạn hiểu rõ hơn về cấu trúc nguyên tử và các ứng dụng liên quan.

.png)
1. Điện Tích Hạt Nhân
Điện tích hạt nhân là một khái niệm cơ bản trong hóa học và vật lý hạt nhân, thể hiện số lượng proton trong hạt nhân của nguyên tử. Điện tích hạt nhân quyết định tính chất hóa học của nguyên tử, đồng thời xác định nguyên tố đó thuộc loại nào trong bảng tuần hoàn.
Điện tích hạt nhân của một nguyên tử được ký hiệu là \( Z \), và có giá trị bằng số proton trong hạt nhân của nguyên tử đó. Mỗi proton mang một đơn vị điện tích dương, vì vậy điện tích hạt nhân của một nguyên tử là một số nguyên dương. Công thức biểu diễn:
\[
Z = p
\]
Trong đó:
- \( Z \): Điện tích hạt nhân
- \( p \): Số lượng proton trong hạt nhân
Các ví dụ về điện tích hạt nhân
- Nguyên tử hydro có điện tích hạt nhân \( Z = 1 \), vì nó chỉ có một proton trong hạt nhân.
- Nguyên tử carbon có điện tích hạt nhân \( Z = 6 \), vì nó có sáu proton trong hạt nhân.
- Nguyên tử uranium có điện tích hạt nhân \( Z = 92 \), vì nó có 92 proton trong hạt nhân.
Điện tích hạt nhân đóng vai trò quyết định trong việc xác định số electron trong nguyên tử, vì số electron trong nguyên tử trung hòa luôn bằng số proton. Điều này ảnh hưởng trực tiếp đến tính chất hóa học của nguyên tố và khả năng tạo liên kết với các nguyên tố khác.
Hiểu rõ điện tích hạt nhân giúp chúng ta giải thích được nhiều hiện tượng hóa học, từ tính chất của các nguyên tố cho đến cách thức chúng phản ứng với nhau.
2. Số Khối
Số khối, ký hiệu là \( A \), là tổng số hạt proton và neutron trong hạt nhân của một nguyên tử. Số khối là một chỉ số quan trọng vì nó giúp xác định khối lượng của nguyên tử, và từ đó, ảnh hưởng đến tính chất vật lý và hóa học của nguyên tố.
Công thức tính số khối được biểu diễn như sau:
\[
A = Z + N
\]
Trong đó:
- \( A \): Số khối của nguyên tử
- \( Z \): Số proton trong hạt nhân
- \( N \): Số neutron trong hạt nhân
Các ví dụ về số khối
- Nguyên tử hydro có một proton và không có neutron, do đó số khối của hydro là \( A = 1 \).
- Nguyên tử carbon có 6 proton và 6 neutron, do đó số khối của carbon là \( A = 12 \).
- Nguyên tử uranium có 92 proton và 146 neutron, do đó số khối của uranium là \( A = 238 \).
Số khối giúp xác định đặc điểm của các đồng vị - các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau. Mặc dù có cùng điện tích hạt nhân, các đồng vị khác nhau sẽ có số khối khác nhau, từ đó tạo nên những tính chất vật lý riêng biệt.
Vai trò của số khối trong hóa học và vật lý
- Số khối được sử dụng để tính toán nguyên tử khối trung bình của một nguyên tố dựa trên sự phân bố của các đồng vị trong tự nhiên.
- Số khối còn được áp dụng trong các phương pháp phân tích khối lượng và các ứng dụng trong vật lý hạt nhân.
Như vậy, số khối không chỉ là một chỉ số cơ bản để xác định nguyên tố mà còn có vai trò quan trọng trong nhiều lĩnh vực khoa học khác nhau.

3. Nguyên Tố Hóa Học
Nguyên tố hóa học là những chất cơ bản không thể phân chia thành những chất đơn giản hơn bằng các phương pháp hóa học thông thường. Mỗi nguyên tố hóa học có số proton nhất định trong hạt nhân, được gọi là số nguyên tử, và đặc trưng bởi ký hiệu hóa học riêng. Nguyên tố hóa học là nền tảng của mọi vật chất và được sắp xếp theo bảng tuần hoàn dựa trên số nguyên tử.
Các nguyên tố hóa học được phân loại thành nhiều nhóm dựa trên tính chất hóa học và vật lý của chúng:
- Kim loại: Những nguyên tố có khả năng dẫn điện và nhiệt tốt, thường có độ bền cao và dễ uốn. Ví dụ: Sắt (Fe), Đồng (Cu).
- Phi kim: Những nguyên tố không có tính chất dẫn điện và dẫn nhiệt tốt như kim loại. Ví dụ: Oxy (O), Carbon (C).
- Bán kim loại: Có tính chất trung gian giữa kim loại và phi kim. Ví dụ: Silic (Si), Asen (As).
- Halogen: Nhóm nguyên tố gồm Flo (F), Clo (Cl), Brom (Br), Iốt (I), và Astatin (At) có tính chất tương đối giống nhau, thường được sử dụng trong các ứng dụng diệt khuẩn và làm sạch.
- Khí hiếm: Các nguyên tố như Helium (He), Neon (Ne) không phản ứng hóa học mạnh và thường ở trạng thái khí.
Nguyên tố hóa học đóng vai trò quan trọng trong các phản ứng hóa học và là cơ sở để hiểu rõ về cấu trúc, tính chất của các chất và hợp chất. Mỗi nguyên tố không chỉ có ứng dụng trong đời sống hàng ngày mà còn trong các lĩnh vực công nghiệp, y học và khoa học môi trường.
XEM THÊM:
4. Nguyên Tử Khối Trung Bình
Nguyên tử khối trung bình là khối lượng trung bình của tất cả các đồng vị của một nguyên tố, tính theo tỷ lệ phần trăm của mỗi đồng vị có trong tự nhiên. Đây là một giá trị rất quan trọng trong việc hiểu rõ hơn về các nguyên tố hóa học và được sử dụng rộng rãi trong nhiều lĩnh vực khoa học và công nghệ.
Để tính nguyên tử khối trung bình của một nguyên tố, ta cần:
- Xác định các đồng vị của nguyên tố đó.
- Biết được khối lượng và tỷ lệ phần trăm của mỗi đồng vị trong tự nhiên.
Công thức tính nguyên tử khối trung bình là:
\[
\text{Nguyên tử khối trung bình} = \frac{{\sum (\text{Khối lượng đồng vị} \times \text{Tỷ lệ phần trăm của đồng vị})}}{100}
\]
Ví dụ: Đối với nguyên tố có hai đồng vị với khối lượng lần lượt là \(m_1\) và \(m_2\), tỷ lệ phần trăm là \(p_1\) và \(p_2\), nguyên tử khối trung bình sẽ là:
\[
\text{Nguyên tử khối trung bình} = \frac{{m_1 \times p_1 + m_2 \times p_2}}{100}
\]
Hiểu và tính toán nguyên tử khối trung bình sẽ giúp bạn trong các bài toán liên quan đến hóa học cơ bản và ứng dụng trong thực tiễn.

5. Đồng Vị
Đồng vị là các dạng của cùng một nguyên tố hóa học nhưng khác nhau về số nơtron trong hạt nhân, do đó, số khối của chúng cũng khác nhau. Mặc dù có sự khác biệt này, các đồng vị của một nguyên tố vẫn có cùng số proton và thường chia sẻ các tính chất hóa học tương tự.
Ví dụ, nguyên tố Hydro có ba đồng vị phổ biến:
- Proti (¹H): Đồng vị nhẹ nhất và phổ biến nhất của Hydro, không có nơtron.
- Deuteri (²H): Có một nơtron, được sử dụng trong nghiên cứu hạt nhân và làm chất chỉ thị trong các phản ứng hóa học.
- Triti (³H): Là đồng vị phóng xạ, có hai nơtron, được sử dụng trong nghiên cứu khoa học và y học.
Hầu hết các nguyên tố tự nhiên tồn tại dưới dạng hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm khác nhau. Chẳng hạn, Clo có hai đồng vị bền là Cl-35 và Cl-37, với tỉ lệ phần trăm lần lượt là 75.77% và 24.23%, tạo nên nguyên tử khối trung bình của Clo xấp xỉ 35.5 u.
Đồng vị có vai trò quan trọng trong nhiều lĩnh vực, chẳng hạn như:
- Y học: Các đồng vị phóng xạ như Technetium-99m được sử dụng trong chẩn đoán hình ảnh.
- Nông nghiệp: Giúp nghiên cứu sự hấp thu dinh dưỡng của cây trồng.
- Công nghiệp: Được dùng để phát hiện khuyết tật trong vật liệu và thăm dò địa chất.