Chủ đề làm mô hình nguyên tử theo bo: Làm mô hình nguyên tử theo Bo là cách hiệu quả để giúp học sinh hiểu rõ hơn về cấu trúc nguyên tử. Bài viết này cung cấp hướng dẫn chi tiết từng bước và các mẹo nhỏ để bạn có thể tạo ra một mô hình trực quan và thú vị, phù hợp cho việc giảng dạy và nghiên cứu khoa học.
Mục lục
- Làm Mô Hình Nguyên Tử Theo Bo
- 1. Giới Thiệu Về Mô Hình Nguyên Tử Theo Bo
- 2. Các Bước Chuẩn Bị Và Nguyên Liệu Làm Mô Hình
- 3. Hướng Dẫn Làm Mô Hình Nguyên Tử Theo Bo
- 4. Ví Dụ Mô Hình Nguyên Tử Thường Gặp
- 5. Phân Tích Toán Học Về Mô Hình Bo
- 6. Lợi Ích Của Việc Làm Mô Hình Nguyên Tử
- 7. Ứng Dụng Của Mô Hình Nguyên Tử Trong Giáo Dục
Làm Mô Hình Nguyên Tử Theo Bo
Mô hình nguyên tử theo Bo là một phương pháp đơn giản và trực quan để giúp chúng ta hiểu về cấu trúc của các nguyên tử. Mô hình này thường được sử dụng trong giảng dạy và nghiên cứu khoa học tự nhiên. Dưới đây là hướng dẫn chi tiết về cách làm mô hình nguyên tử theo mô hình Bo.
1. Nguyên Liệu Chuẩn Bị
- Viên bi nhựa màu đỏ (đại diện cho proton và neutron)
- Viên bi nhỏ màu xanh (đại diện cho electron)
- Bìa carton hoặc giấy cứng
- Kéo, keo dán, bút vẽ
- Dây chun hoặc dây nylon
2. Các Bước Thực Hiện
- Tạo hạt nhân nguyên tử: Sử dụng các viên bi màu đỏ để đại diện cho proton và neutron, dính chúng lại với nhau thành một cụm làm hạt nhân của nguyên tử.
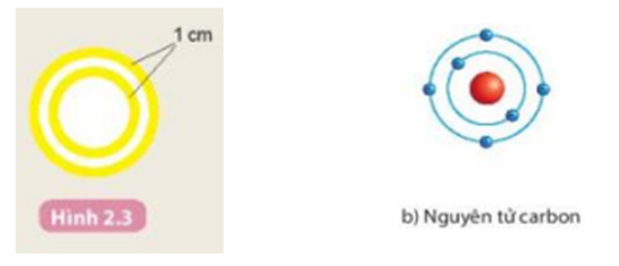
- Vẽ và cắt quỹ đạo electron: Sử dụng bìa carton để vẽ và cắt các vòng quỹ đạo. Số lượng vòng quỹ đạo phụ thuộc vào loại nguyên tử mà bạn muốn làm mô hình. Ví dụ: nguyên tử carbon có hai lớp quỹ đạo.
- Gắn electron: Dùng dây chun hoặc dây nylon để gắn các viên bi nhỏ màu xanh vào các quỹ đạo tương ứng. Electron sẽ được đặt trên các quỹ đạo đã cắt và sắp xếp sao cho đúng với số lượng electron của nguyên tử.
- Hoàn thiện mô hình: Sắp xếp tất cả các thành phần lại với nhau để tạo thành một mô hình hoàn chỉnh của nguyên tử.
3. Ví Dụ Cụ Thể: Mô Hình Nguyên Tử Carbon
Nguyên tử carbon có 6 proton, 6 neutron và 6 electron. Để mô tả nó theo mô hình Bo, bạn sẽ làm như sau:
- Hạt nhân bao gồm 6 proton và 6 neutron.
- Quỹ đạo đầu tiên chứa 2 electron, quỹ đạo thứ hai chứa 4 electron.
4. Công Thức Toán Học Liên Quan
Mô hình nguyên tử Bo dựa trên các nguyên tắc toán học, trong đó khoảng cách giữa các quỹ đạo electron được xác định bằng công thức:
Trong đó:
- \(r_n\): Bán kính quỹ đạo electron thứ \(n\)
- \(r_1\): Bán kính quỹ đạo đầu tiên
- \(n\): Số thứ tự của quỹ đạo
5. Ý Nghĩa Giáo Dục
Việc làm mô hình nguyên tử theo Bo không chỉ giúp hiểu rõ về cấu trúc nguyên tử mà còn thúc đẩy sự sáng tạo và khả năng tư duy khoa học của học sinh. Đây là một công cụ giáo dục hiệu quả, mang tính trực quan và dễ tiếp cận.

.png)
1. Giới Thiệu Về Mô Hình Nguyên Tử Theo Bo
Mô hình nguyên tử theo Bo là một trong những bước tiến quan trọng trong việc hiểu rõ cấu trúc của nguyên tử. Được nhà vật lý người Đan Mạch Niels Bohr đề xuất vào năm 1913, mô hình này giúp giải thích cách các electron di chuyển xung quanh hạt nhân của nguyên tử và năng lượng liên quan đến các quỹ đạo electron.
Mô hình Bo dựa trên các nguyên lý cơ bản của cơ học lượng tử, nhưng vẫn giữ lại một số yếu tố từ mô hình nguyên tử cổ điển. Nó mang lại một cái nhìn đơn giản hơn về cấu trúc nguyên tử, phù hợp cho mục đích giảng dạy và nghiên cứu khoa học.
- Mô hình Bo giải thích rằng các electron chỉ có thể di chuyển trên các quỹ đạo cụ thể, gọi là quỹ đạo dừng.
- Khi electron nhảy từ quỹ đạo này sang quỹ đạo khác, nó sẽ phát ra hoặc hấp thụ một lượng năng lượng xác định dưới dạng photon.
- Mỗi quỹ đạo electron tương ứng với một mức năng lượng cụ thể, được tính toán dựa trên công thức:
Trong đó:
- \(E_n\): Năng lượng của electron ở quỹ đạo thứ \(n\)
- \(n\): Số nguyên tương ứng với quỹ đạo electron (1, 2, 3,...)
Nhờ vào mô hình Bo, ta có thể giải thích nhiều hiện tượng vật lý quan trọng như quang phổ của các nguyên tử hydrogen, điều này góp phần làm sáng tỏ các nguyên lý cơ bản trong vật lý nguyên tử.
2. Các Bước Chuẩn Bị Và Nguyên Liệu Làm Mô Hình
Để làm một mô hình nguyên tử theo Bo, bạn cần chuẩn bị các nguyên liệu và công cụ cơ bản. Dưới đây là hướng dẫn từng bước chi tiết cùng danh sách các nguyên liệu cần thiết.
-
Chuẩn bị nguyên liệu:
- Bóng xốp nhỏ (để làm hạt nhân và electron)
- Dây kẽm hoặc dây nhựa (để làm quỹ đạo electron)
- Kéo, keo dán
- Bút màu hoặc sơn (để tô màu electron và hạt nhân)
- Giấy bìa hoặc khung làm nền cho mô hình
-
Các bước thực hiện:
- Tạo hạt nhân nguyên tử: Dùng bóng xốp lớn hơn làm hạt nhân. Bạn có thể tô màu để mô phỏng các proton và neutron.
- Làm quỹ đạo electron: Dùng dây kẽm hoặc dây nhựa uốn thành các vòng tròn, tượng trưng cho quỹ đạo của các electron xung quanh hạt nhân. Mỗi vòng tương ứng với một mức năng lượng cụ thể.
- Gắn electron: Gắn các bóng xốp nhỏ hơn (đã được tô màu) lên các quỹ đạo bằng keo hoặc dây để tạo thành electron. Lưu ý gắn đúng số lượng electron trên từng quỹ đạo theo nguyên lý Bo.
- Lắp ráp mô hình: Gắn quỹ đạo electron lên giấy bìa hoặc khung nền để mô hình nguyên tử hoàn chỉnh và dễ dàng di chuyển.
Khi đã hoàn thành, mô hình của bạn sẽ trực quan và sinh động, giúp hiểu rõ hơn về cách các electron di chuyển quanh hạt nhân theo lý thuyết Bo.

3. Hướng Dẫn Làm Mô Hình Nguyên Tử Theo Bo
Làm mô hình nguyên tử theo Bo là một cách thú vị để hiểu sâu hơn về lý thuyết nguyên tử. Dưới đây là hướng dẫn chi tiết từng bước để bạn có thể thực hiện mô hình này một cách dễ dàng.
- Tạo hạt nhân nguyên tử:
- Sử dụng một quả bóng xốp lớn, biểu tượng cho hạt nhân nguyên tử. Hãy tô màu đỏ cho proton và màu trắng cho neutron để phân biệt hai loại hạt này.
- Số lượng proton và neutron tùy thuộc vào nguyên tố bạn chọn. Ví dụ, với nguyên tử hydrogen, chỉ cần một proton.
- Chuẩn bị các quỹ đạo electron:
- Sử dụng dây kẽm hoặc nhựa mềm để tạo các vòng tròn đại diện cho quỹ đạo của các electron.
- Mỗi vòng tròn tượng trưng cho một mức năng lượng của electron, được xác định bằng chỉ số \(n\). Với \(n = 1, 2, 3,...\), ta có thể tính toán các mức năng lượng tương ứng theo công thức:
- Vòng tròn gần nhất với hạt nhân là quỹ đạo đầu tiên, có mức năng lượng cao nhất (quỹ đạo \(n = 1\)).
- Gắn electron vào quỹ đạo:
- Dùng các quả bóng xốp nhỏ, tô màu xanh hoặc vàng để biểu thị electron.
- Dán các quả bóng này lên các quỹ đạo đã chuẩn bị, đảm bảo số lượng electron đúng với số lượng quỹ đạo tương ứng.
- Ví dụ, với mô hình nguyên tử hydrogen, chỉ cần một electron ở quỹ đạo \(n = 1\).
- Hoàn thiện mô hình:
- Gắn các quỹ đạo electron vào hạt nhân nguyên tử. Bạn có thể sử dụng keo hoặc dây để cố định chúng lại.
- Đặt mô hình lên một mặt phẳng hoặc khung để mô hình được chắc chắn và dễ dàng trình bày.
Với mô hình này, bạn sẽ có cái nhìn trực quan hơn về cách các electron di chuyển xung quanh hạt nhân theo lý thuyết của Bo, từ đó hiểu rõ hơn về cấu trúc nguyên tử và các mức năng lượng liên quan.
XEM THÊM:
4. Ví Dụ Mô Hình Nguyên Tử Thường Gặp
Dưới đây là một số ví dụ mô hình nguyên tử theo Bo thường gặp trong các bài học và thực hành, giúp bạn dễ hình dung hơn về cấu trúc của các nguyên tử.
- Mô hình nguyên tử hydrogen (H):
Hydrogen là nguyên tử đơn giản nhất với chỉ một proton và một electron. Mô hình của nó bao gồm:
- Hạt nhân: 1 proton.
- Quỹ đạo electron: 1 electron chuyển động quanh hạt nhân trong quỹ đạo \(n = 1\).
Với công thức năng lượng Bo, năng lượng electron ở trạng thái cơ bản của hydrogen là:
\[ E_1 = -13.6 \, \text{eV} \] - Mô hình nguyên tử helium (He):
Helium là nguyên tử có 2 proton và 2 neutron trong hạt nhân. Mô hình của nó gồm:
- Hạt nhân: 2 proton và 2 neutron.
- Quỹ đạo electron: 2 electron ở quỹ đạo \(n = 1\).
Vì helium có nhiều hơn một electron, các electron tương tác với nhau, khiến việc tính toán năng lượng phức tạp hơn so với hydrogen.
- Mô hình nguyên tử lithium (Li):
Lithium là nguyên tử có 3 proton, 3 neutron và 3 electron. Mô hình của nó như sau:
- Hạt nhân: 3 proton và 3 neutron.
- Quỹ đạo electron:
- 2 electron ở quỹ đạo \(n = 1\).
- 1 electron ở quỹ đạo \(n = 2\).
Mô hình lithium cho thấy rằng các electron bắt đầu lấp đầy các mức năng lượng cao hơn sau khi quỹ đạo đầu tiên đã đủ electron.
- Mô hình nguyên tử carbon (C):
Carbon có 6 proton, 6 neutron và 6 electron. Cấu trúc của nó bao gồm:
- Hạt nhân: 6 proton và 6 neutron.
- Quỹ đạo electron:
- 2 electron ở quỹ đạo \(n = 1\).
- 4 electron ở quỹ đạo \(n = 2\).
Mô hình carbon là nền tảng của nhiều hợp chất hữu cơ và đóng vai trò quan trọng trong sinh học và hóa học.
Các mô hình này giúp minh họa cách các electron được sắp xếp quanh hạt nhân nguyên tử và mức năng lượng tương ứng của chúng theo lý thuyết Bo.

5. Phân Tích Toán Học Về Mô Hình Bo
Mô hình nguyên tử Bo dựa trên cơ học lượng tử và định luật Coulomb, giúp giải thích chuyển động của electron trong nguyên tử thông qua các quỹ đạo cố định. Phân tích toán học của mô hình này tập trung vào công thức tính bán kính quỹ đạo và năng lượng của electron trong các mức năng lượng khác nhau.
- Bán kính quỹ đạo Bo:
Bán kính quỹ đạo Bo là khoảng cách từ hạt nhân đến electron ở trạng thái năng lượng thấp nhất. Công thức tính bán kính quỹ đạo của electron trong mức năng lượng \(n\) là:
\[ r_n = n^2 \cdot r_1 \]Trong đó:
- \(r_n\) là bán kính quỹ đạo của mức năng lượng \(n\).
- \(r_1 = 0.529 \, \text{Å}\) là bán kính Bo ở trạng thái cơ bản.
- \(n\) là số nguyên dương chỉ mức năng lượng của electron.
- Năng lượng của electron trong quỹ đạo:
Năng lượng của electron trong một mức năng lượng \(n\) được tính bằng công thức:
\[ E_n = - \frac{13.6 \, \text{eV}}{n^2} \]Trong đó:
- \(E_n\) là năng lượng của electron ở mức \(n\).
- \(n\) là số nguyên dương đại diện cho quỹ đạo.
- Giá trị -13.6 eV là năng lượng của electron ở trạng thái cơ bản (\(n = 1\)).
- Tần số của bức xạ phát ra:
Khi electron chuyển từ mức năng lượng cao hơn về mức thấp hơn, nó phát ra một photon với tần số được xác định bởi hiệu số năng lượng giữa hai mức. Công thức tính tần số bức xạ là:
\[ f = \frac{E_i - E_f}{h} \]Trong đó:
- \(f\) là tần số của bức xạ phát ra.
- \(E_i\) và \(E_f\) là năng lượng của electron ở các mức ban đầu và cuối cùng.
- \(h = 6.626 \times 10^{-34} \, \text{J·s}\) là hằng số Planck.
Các công thức trên cung cấp cái nhìn toán học về mô hình nguyên tử Bo, cho phép tính toán bán kính quỹ đạo, năng lượng của electron và tần số của bức xạ phát ra khi electron chuyển đổi giữa các mức năng lượng.
6. Lợi Ích Của Việc Làm Mô Hình Nguyên Tử
Việc làm mô hình nguyên tử không chỉ giúp hiểu sâu hơn về cấu trúc nguyên tử mà còn mang lại nhiều lợi ích giáo dục và sáng tạo. Đây là một phương pháp hiệu quả để nắm bắt kiến thức khoa học một cách trực quan và thực tế.
- Củng cố kiến thức vật lý:
Thông qua quá trình xây dựng mô hình, học sinh và người học có cơ hội áp dụng các lý thuyết về cấu trúc nguyên tử vào thực tiễn, giúp củng cố kiến thức về vật lý hạt nhân và cơ học lượng tử.
- Phát triển kỹ năng sáng tạo:
Làm mô hình đòi hỏi sự sáng tạo và kỹ năng thiết kế, từ việc chọn lựa nguyên liệu đến việc sắp xếp các thành phần của nguyên tử như proton, neutron và electron. Điều này kích thích khả năng sáng tạo và tư duy hình ảnh không gian.
- Học qua thực hành:
Thực hành làm mô hình giúp học sinh hiểu rõ hơn về cách các nguyên tử hoạt động và tương tác. Đây là cách tiếp cận trực quan, giúp người học dễ dàng hình dung và liên kết kiến thức lý thuyết với thực tế.
- Nâng cao tư duy logic và phân tích:
Quá trình tạo mô hình yêu cầu người học phân tích, sắp xếp các phần tử theo cấu trúc logic, từ đó phát triển khả năng tư duy logic và kỹ năng giải quyết vấn đề.
Tóm lại, việc làm mô hình nguyên tử không chỉ là một hoạt động thú vị mà còn mang lại nhiều lợi ích trong học tập, giúp nâng cao tư duy, kỹ năng và kiến thức khoa học một cách trực quan và hiệu quả.
7. Ứng Dụng Của Mô Hình Nguyên Tử Trong Giáo Dục
Mô hình nguyên tử theo Bo không chỉ là một công cụ minh họa lý thuyết trong hóa học và vật lý, mà còn đóng vai trò quan trọng trong giáo dục, giúp học sinh và sinh viên hiểu rõ hơn về cấu trúc của nguyên tử và các hiện tượng liên quan. Dưới đây là một số ứng dụng của mô hình nguyên tử theo Bo trong giáo dục:
7.1 Ứng dụng trong giảng dạy môn Khoa học Tự nhiên
Mô hình nguyên tử theo Bo được sử dụng rộng rãi trong giảng dạy môn Khoa học Tự nhiên, đặc biệt là trong các bài học về cấu trúc nguyên tử, quỹ đạo electron và năng lượng mức. Việc sử dụng mô hình giúp học sinh:
- Trực quan hóa các khái niệm trừu tượng như quỹ đạo electron, mức năng lượng, và sự chuyển động của electron.
- Hiểu rõ hơn về cách các electron phân bố xung quanh hạt nhân và cách chúng di chuyển giữa các mức năng lượng.
- Dễ dàng tiếp cận và nắm bắt các khái niệm phức tạp thông qua việc quan sát và tương tác trực tiếp với mô hình.
7.2 Vai trò của mô hình trong nghiên cứu khoa học
Mô hình nguyên tử theo Bo cũng có vai trò quan trọng trong nghiên cứu khoa học. Việc xây dựng và phân tích mô hình giúp sinh viên và nhà nghiên cứu:
- Phát triển tư duy phân tích và kỹ năng giải quyết vấn đề thông qua việc mô phỏng các hiện tượng vật lý và hóa học.
- Thử nghiệm các giả thuyết về cấu trúc nguyên tử và cơ chế hoạt động của các hạt dưới mức nguyên tử.
- Ứng dụng các công thức toán học để giải quyết các bài toán về quỹ đạo electron, mức năng lượng, và sự tương tác giữa các hạt.
Ví dụ, với công thức tính bán kính quỹ đạo electron theo Bo:
trong đó \(r_n\) là bán kính quỹ đạo của electron ở mức năng lượng n, \(h\) là hằng số Planck, \(m\) là khối lượng electron, \(e\) là điện tích của electron, và \(a_0\) là bán kính Bo.
Những kiến thức này không chỉ hỗ trợ trong học tập mà còn giúp học sinh, sinh viên phát triển kỹ năng tư duy logic và phân tích.













