Chủ đề bán kính nguyên tử: Bán kính nguyên tử đóng vai trò quan trọng trong việc hiểu rõ cấu trúc và tính chất của nguyên tố. Bài viết này sẽ giúp bạn khám phá khái niệm bán kính nguyên tử, các yếu tố ảnh hưởng, cũng như những ứng dụng quan trọng trong hóa học và công nghệ hiện đại, giúp bạn nắm bắt kiến thức một cách toàn diện và sâu sắc.
Mục lục
- Bán Kính Nguyên Tử: Khái Niệm và Ứng Dụng
- 1. Giới Thiệu về Bán Kính Nguyên Tử
- 2. Các Yếu Tố Ảnh Hưởng đến Bán Kính Nguyên Tử
- 3. So Sánh Bán Kính Nguyên Tử Theo Chu Kỳ và Nhóm
- 4. Bán Kính Nguyên Tử và Tính Chất Hóa Học
- 5. Bán Kính Nguyên Tử và Bán Kính Ion
- 6. Phương Pháp Xác Định Bán Kính Nguyên Tử
- 7. Ứng Dụng Của Bán Kính Nguyên Tử Trong Khoa Học và Công Nghệ
- 8. Kết Luận
Bán Kính Nguyên Tử: Khái Niệm và Ứng Dụng
Bán kính nguyên tử là khoảng cách từ hạt nhân đến lớp electron ngoài cùng của một nguyên tử trung hòa. Đây là một thông số quan trọng trong việc xác định kích thước và tính chất của các nguyên tố hóa học.
1. Bán Kính Nguyên Tử Theo Chu Kỳ
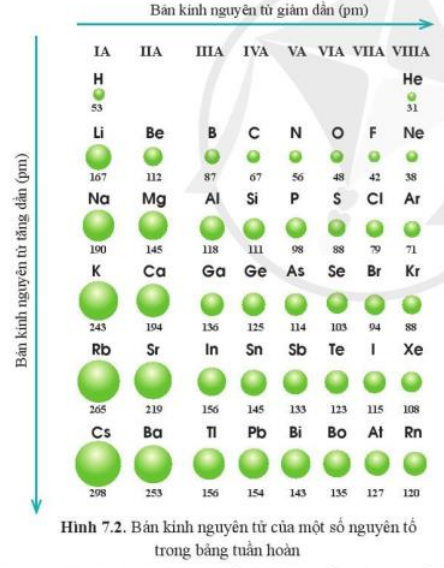
Trong một chu kỳ của bảng tuần hoàn, bán kính nguyên tử có xu hướng giảm dần từ trái sang phải. Điều này là do số lượng proton trong hạt nhân tăng lên, làm tăng lực hút giữa hạt nhân và các electron, kéo các electron lại gần hạt nhân hơn, từ đó làm giảm bán kính nguyên tử.
| Nguyên tố | Bán kính nguyên tử (pm) | Điện tích hạt nhân |
|---|---|---|
| Lithium (Li) | 152 | +3 |
| Beryllium (Be) | 112 | +4 |
| Boron (B) | 98 | +5 |
| Carbon (C) | 77 | +6 |
| Nitrogen (N) | 75 | +7 |
| Oxygen (O) | 73 | +8 |
| Fluorine (F) | 72 | +9 |
| Neon (Ne) | 71 | +10 |
2. Bán Kính Nguyên Tử Theo Nhóm
Trong một nhóm của bảng tuần hoàn, bán kính nguyên tử tăng dần từ trên xuống dưới. Sự tăng này là do số lớp electron tăng lên khi đi từ trên xuống dưới trong một nhóm, làm cho các electron nằm xa hạt nhân hơn.
| Nguyên tố | Bán kính nguyên tử (pm) | Nhóm |
|---|---|---|
| Lithium (Li) | 152 | IA |
| Sodium (Na) | 186 | IA |
| Potassium (K) | 231 | IA |
| Rubidium (Rb) | 244 | IA |
| Cesium (Cs) | 262 | IA |
3. Bán Kính Nguyên Tử và Bán Kính Ion
Bán kính nguyên tử và bán kính ion là hai khái niệm liên quan nhưng có sự khác biệt rõ ràng:
- Nguyên tử trung hòa: Bán kính nguyên tử đo khoảng cách từ hạt nhân đến lớp electron ngoài cùng của một nguyên tử trung hòa.
- Ion: Khi nguyên tử mất hoặc nhận thêm electron, nó trở thành ion. Bán kính ion thay đổi tùy thuộc vào số lượng và phân bố electron.
- Cation (Ion dương): Bán kính cation thường nhỏ hơn bán kính nguyên tử trung hòa do mất đi electron và lực hút hạt nhân mạnh hơn lên các electron còn lại.
- Anion (Ion âm): Bán kính anion lớn hơn bán kính nguyên tử trung hòa do nhận thêm electron, dẫn đến lực hút yếu hơn giữa hạt nhân và các electron ngoài cùng.
Như vậy, bán kính nguyên tử là một chỉ số quan trọng giúp chúng ta hiểu rõ hơn về tính chất và hành vi của các nguyên tố và ion trong các phản ứng hóa học.

.png)
1. Giới Thiệu về Bán Kính Nguyên Tử
Bán kính nguyên tử là khái niệm quan trọng trong hóa học, dùng để chỉ khoảng cách từ hạt nhân đến electron ngoài cùng của một nguyên tử. Khái niệm này giúp chúng ta hiểu rõ hơn về kích thước và tính chất của các nguyên tử trong bảng tuần hoàn.
Mỗi nguyên tử có bán kính khác nhau, phụ thuộc vào số lượng proton trong hạt nhân và mức năng lượng của các electron. Bán kính nguyên tử có xu hướng giảm dần khi di chuyển từ trái sang phải trong cùng một chu kỳ của bảng tuần hoàn do lực hút giữa proton và electron tăng lên.
Trong khi đó, khi di chuyển từ trên xuống dưới trong cùng một nhóm, bán kính nguyên tử lại tăng lên vì số lượng lớp electron tăng lên, làm giảm lực hút hiệu dụng giữa hạt nhân và electron ngoài cùng.
Ví dụ, bán kính nguyên tử của nguyên tố hydrogen \((H)\) nhỏ hơn nhiều so với các nguyên tố ở dưới trong cùng nhóm như lithium \((Li)\), natri \((Na)\), hoặc kali \((K)\).
- Bán kính nguyên tử của kim loại thường lớn hơn phi kim, vì kim loại có xu hướng mất electron dễ dàng, làm tăng kích thước ion.
- Bán kính nguyên tử của phi kim nhỏ hơn, do lực hút mạnh giữa hạt nhân và electron, đặc biệt là ở các nguyên tố như fluorine \((F)\) và oxygen \((O)\).
Bán kính nguyên tử không chỉ là một con số mô tả kích thước của nguyên tử, mà còn phản ánh nhiều tính chất hóa học và vật lý quan trọng, như năng lượng ion hóa, độ âm điện và cấu trúc mạng tinh thể.
2. Các Yếu Tố Ảnh Hưởng đến Bán Kính Nguyên Tử
Bán kính nguyên tử của một nguyên tố không cố định mà bị ảnh hưởng bởi nhiều yếu tố khác nhau. Dưới đây là các yếu tố chính tác động đến bán kính nguyên tử:
- Số lượng proton trong hạt nhân: Proton mang điện tích dương, thu hút các electron quay quanh hạt nhân. Khi số lượng proton tăng lên, lực hút giữa hạt nhân và electron cũng tăng, kéo các electron gần lại, làm giảm bán kính nguyên tử.
- Số lượng lớp electron: Khi số lượng lớp electron tăng lên, bán kính nguyên tử tăng do các lớp electron bên ngoài ít bị ảnh hưởng bởi lực hút từ hạt nhân. Điều này giải thích tại sao bán kính nguyên tử tăng khi di chuyển từ trên xuống dưới trong cùng một nhóm của bảng tuần hoàn.
- Hiệu ứng chắn: Các electron ở lớp trong cùng có thể chắn bớt lực hút từ hạt nhân lên các electron ở lớp ngoài cùng. Điều này làm giảm lực hút hiệu dụng, khiến bán kính nguyên tử lớn hơn.
- Độ âm điện: Các nguyên tố có độ âm điện cao thường có bán kính nguyên tử nhỏ hơn do lực hút giữa hạt nhân và electron mạnh hơn, giữ các electron gần hạt nhân hơn.
- Liên kết hóa học: Trong một số cấu trúc tinh thể, bán kính nguyên tử có thể thay đổi do tác động của liên kết hóa học với các nguyên tử khác, đặc biệt trong các hợp chất ion và kim loại.
Ví dụ, khi di chuyển từ trái sang phải trong cùng một chu kỳ của bảng tuần hoàn, số lượng proton tăng lên, nhưng số lượng lớp electron không đổi, dẫn đến bán kính nguyên tử giảm dần. Trong khi đó, khi di chuyển từ trên xuống dưới trong cùng một nhóm, bán kính nguyên tử tăng do số lượng lớp electron tăng, mặc dù lực hút từ hạt nhân có thể tăng.
Những yếu tố này đều đóng vai trò quan trọng trong việc xác định kích thước của nguyên tử và ảnh hưởng trực tiếp đến các tính chất hóa học của các nguyên tố.

3. So Sánh Bán Kính Nguyên Tử Theo Chu Kỳ và Nhóm
Bán kính nguyên tử thay đổi theo các chu kỳ và nhóm trong bảng tuần hoàn, phản ánh sự khác biệt về cấu trúc điện tử và lực tương tác giữa hạt nhân và các electron.
- Theo Chu Kỳ: Khi di chuyển từ trái sang phải trong cùng một chu kỳ, bán kính nguyên tử có xu hướng giảm. Điều này xảy ra do số lượng proton trong hạt nhân tăng lên, làm tăng lực hút giữa hạt nhân và electron, kéo electron gần lại hơn. Ví dụ, trong chu kỳ 2, bán kính nguyên tử của lithium \((Li)\) lớn hơn nhiều so với fluorine \((F)\).
- Theo Nhóm: Khi di chuyển từ trên xuống dưới trong cùng một nhóm, bán kính nguyên tử có xu hướng tăng. Điều này là do số lượng lớp electron tăng lên, làm giảm lực hút hiệu dụng giữa hạt nhân và electron ngoài cùng, khiến kích thước nguyên tử lớn hơn. Ví dụ, trong nhóm 1, bán kính nguyên tử của cesium \((Cs)\) lớn hơn nhiều so với lithium \((Li)\).
Điều này dẫn đến một quy luật tổng quát trong bảng tuần hoàn: bán kính nguyên tử giảm dần khi di chuyển từ trái sang phải trong một chu kỳ, và tăng dần khi di chuyển từ trên xuống dưới trong một nhóm.
Sự thay đổi này không chỉ ảnh hưởng đến kích thước nguyên tử mà còn tác động đến nhiều tính chất hóa học khác, như năng lượng ion hóa và độ âm điện. Việc hiểu rõ sự khác biệt về bán kính nguyên tử giúp chúng ta nắm bắt được lý do tại sao các nguyên tố có tính chất hóa học khác nhau theo chu kỳ và nhóm trong bảng tuần hoàn.

XEM THÊM:
4. Bán Kính Nguyên Tử và Tính Chất Hóa Học
Bán kính nguyên tử là một yếu tố quan trọng ảnh hưởng đến tính chất hóa học của các nguyên tố. Sự thay đổi bán kính nguyên tử có thể tác động đến khả năng phản ứng, độ âm điện, và năng lượng ion hóa của nguyên tố.
- Khả Năng Phản Ứng: Các nguyên tố có bán kính nguyên tử lớn thường có xu hướng dễ dàng mất electron hơn, điều này làm tăng tính phản ứng. Ví dụ, trong nhóm kim loại kiềm, cesium \((Cs)\) có bán kính nguyên tử lớn nhất và cũng là kim loại phản ứng mạnh nhất.
- Độ Âm Điện: Độ âm điện của một nguyên tố thường giảm khi bán kính nguyên tử tăng. Điều này là do lực hút của hạt nhân đối với electron giảm đi khi khoảng cách giữa chúng tăng. Như vậy, fluorine \((F)\) có bán kính nguyên tử nhỏ nhất và cũng có độ âm điện cao nhất trong các nguyên tố.
- Năng Lượng Ion Hóa: Năng lượng cần thiết để loại bỏ một electron ra khỏi nguyên tử, hay còn gọi là năng lượng ion hóa, thường giảm khi bán kính nguyên tử tăng. Điều này là do lực hút giữa hạt nhân và electron giảm, khiến electron dễ bị tách ra hơn. Ví dụ, năng lượng ion hóa của francium \((Fr)\) nhỏ hơn nhiều so với helium \((He)\).
Tóm lại, sự thay đổi bán kính nguyên tử không chỉ ảnh hưởng đến kích thước nguyên tử mà còn tác động đến tính chất hóa học của nguyên tố, từ khả năng phản ứng cho đến năng lượng ion hóa và độ âm điện.

5. Bán Kính Nguyên Tử và Bán Kính Ion
Bán kính nguyên tử và bán kính ion là hai khái niệm quan trọng trong hóa học, liên quan chặt chẽ đến kích thước của các nguyên tử và ion trong các trạng thái khác nhau. Sự khác biệt giữa bán kính nguyên tử và bán kính ion chủ yếu xuất phát từ sự thay đổi cấu trúc điện tử khi nguyên tử nhận hoặc mất electron.
- Bán Kính Nguyên Tử: Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ngoài cùng của nguyên tử. Khi di chuyển theo chu kỳ từ trái sang phải trong bảng tuần hoàn, bán kính nguyên tử giảm do lực hút giữa hạt nhân và các electron tăng lên. Ngược lại, khi di chuyển xuống trong một nhóm, bán kính nguyên tử tăng do sự gia tăng số lượng lớp electron.
- Bán Kính Ion: Bán kính ion được xác định khi nguyên tử biến đổi thành ion bằng cách mất hoặc nhận electron. Nếu nguyên tử mất electron để trở thành ion dương \((cation)\), bán kính ion sẽ nhỏ hơn bán kính nguyên tử do lực hút giữa hạt nhân và các electron còn lại tăng lên. Ngược lại, nếu nguyên tử nhận thêm electron để trở thành ion âm \((anion)\), bán kính ion sẽ lớn hơn bán kính nguyên tử do lực đẩy giữa các electron tăng lên.
Ví dụ, trong trường hợp của natri \((Na)\), khi nguyên tử natri mất một electron để trở thành ion \(Na^+\), bán kính ion của \(Na^+\) nhỏ hơn nhiều so với bán kính nguyên tử của natri. Ngược lại, khi clo \((Cl)\) nhận thêm một electron để trở thành ion \(Cl^-\), bán kính ion của \(Cl^-\) lớn hơn bán kính nguyên tử của clo.
Việc so sánh bán kính nguyên tử và bán kính ion giúp hiểu rõ hơn về sự thay đổi kích thước khi nguyên tử tham gia vào các phản ứng hóa học, cũng như tác động của các quá trình ion hóa đến cấu trúc và tính chất của các nguyên tố.
6. Phương Pháp Xác Định Bán Kính Nguyên Tử
Xác định bán kính nguyên tử là một quá trình phức tạp và đòi hỏi sự chính xác cao. Dưới đây là một số phương pháp phổ biến được sử dụng để đo lường và tính toán bán kính nguyên tử:
- Phương Pháp X-ray Diffraction (Nhiễu Xạ Tia X): Phương pháp này sử dụng tia X để đo khoảng cách giữa các nguyên tử trong mạng tinh thể. Kết quả từ nhiễu xạ tia X giúp tính toán bán kính nguyên tử dựa trên cấu trúc tinh thể và khoảng cách giữa các nguyên tử liền kề.
- Phương Pháp Spektroskopi Hấp Thụ: Phương pháp này dựa trên việc đo lường sự hấp thụ năng lượng của các nguyên tử khi chúng chuyển từ trạng thái năng lượng thấp lên cao. Thông qua các bước sóng hấp thụ, có thể suy ra bán kính nguyên tử.
- Phương Pháp Toán Học (Lý Thuyết): Sử dụng các mô hình lý thuyết và phương trình toán học để tính toán bán kính nguyên tử. Một số phương trình như phương trình Schrödinger giúp dự đoán bán kính nguyên tử dựa trên các đặc tính điện tử và hạt nhân.
Trong nhiều trường hợp, các phương pháp này được sử dụng kết hợp để đảm bảo độ chính xác cao nhất trong việc xác định bán kính nguyên tử, giúp hiểu rõ hơn về cấu trúc và tính chất của các nguyên tử trong hóa học và vật lý.
7. Ứng Dụng Của Bán Kính Nguyên Tử Trong Khoa Học và Công Nghệ
7.1 Ứng Dụng Trong Ngành Hóa Học Vật Liệu
Bán kính nguyên tử đóng vai trò quan trọng trong việc xác định tính chất và cấu trúc của vật liệu hóa học. Kích thước nguyên tử ảnh hưởng trực tiếp đến khả năng phản ứng, tính dẫn điện, và độ bền của vật liệu.
- Thiết kế hợp chất mới: Sử dụng bán kính nguyên tử để dự đoán tính chất của hợp chất trước khi tổng hợp, giúp tối ưu hóa quy trình nghiên cứu và sản xuất.
- Điều chỉnh tính chất cơ học: Thay đổi bán kính nguyên tử của các nguyên tố trong hợp chất có thể làm thay đổi độ cứng, độ giãn nở và khả năng chống mài mòn của vật liệu.
7.2 Ứng Dụng Trong Thiết Kế và Chế Tạo Vật Liệu Nano
Trong công nghệ nano, việc kiểm soát bán kính nguyên tử rất quan trọng để tạo ra các vật liệu với tính chất đặc biệt, phù hợp với các yêu cầu kỹ thuật cao.
- Tối ưu hóa kích thước hạt nano: Việc sử dụng bán kính nguyên tử giúp điều chỉnh kích thước hạt nano nhằm tăng cường tính chất quang học, từ tính hoặc xúc tác.
- Tạo lớp phủ bảo vệ: Kiểm soát bán kính nguyên tử giúp chế tạo các lớp phủ mỏng với độ bền cao và khả năng chống ăn mòn, giúp bảo vệ vật liệu trong môi trường khắc nghiệt.
- Phát triển cảm biến nano: Cảm biến được thiết kế dựa trên bán kính nguyên tử có thể đo lường chính xác các biến đổi nhỏ về nhiệt độ, áp suất, hoặc nồng độ hóa chất.
7.3 Ứng Dụng Trong Y Sinh Học và Dược Học
Bán kính nguyên tử cũng có vai trò quan trọng trong y sinh học và dược học, nơi việc hiểu rõ kích thước nguyên tử giúp phát triển các phương pháp điều trị tiên tiến.
- Thiết kế thuốc chính xác: Dựa vào bán kính nguyên tử, các nhà khoa học có thể thiết kế các phân tử thuốc có khả năng gắn kết chặt chẽ với mục tiêu sinh học, tối ưu hóa hiệu quả điều trị.
- Phát triển vật liệu cấy ghép: Bán kính nguyên tử được sử dụng để điều chỉnh tính chất của các vật liệu cấy ghép, giúp chúng tương thích tốt hơn với cơ thể người và giảm nguy cơ thải ghép.
- Cải tiến công nghệ hình ảnh y học: Bán kính nguyên tử ảnh hưởng đến khả năng phát quang của các vật liệu được sử dụng trong các thiết bị chẩn đoán hình ảnh, như máy chụp cộng hưởng từ (MRI).

8. Kết Luận
Kết luận về bán kính nguyên tử giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố hóa học. Bán kính nguyên tử là một trong những yếu tố quan trọng ảnh hưởng đến tính chất vật lý và hóa học của nguyên tố, từ sự phản ứng hóa học đến tính chất vật liệu. Nhờ vào kiến thức này, các nhà khoa học có thể tối ưu hóa các phản ứng hóa học, phát triển các vật liệu mới, và thậm chí cải tiến các công nghệ hiện đại.
Các yếu tố ảnh hưởng đến bán kính nguyên tử như điện tích hạt nhân, số lớp electron, và tương tác giữa các electron giúp xác định chính xác kích thước nguyên tử. Sự biến đổi của bán kính nguyên tử theo chu kỳ và nhóm trong bảng tuần hoàn thể hiện mối quan hệ phức tạp giữa cấu trúc nguyên tử và tính chất hóa học của các nguyên tố.
Điều này không chỉ dừng lại ở lý thuyết mà còn có những ứng dụng thực tiễn quan trọng. Trong ngành công nghệ vật liệu, bán kính nguyên tử được sử dụng để dự đoán và thiết kế các tính chất của hợp chất mới, giúp tạo ra những vật liệu có tính năng ưu việt hơn. Bên cạnh đó, việc hiểu rõ sự thay đổi bán kính nguyên tử còn giúp cải thiện hiệu suất của các thiết bị điện tử thông qua việc tối ưu hóa khoảng cách giữa các nguyên tử trong cấu trúc vật liệu.
Tóm lại, việc nghiên cứu và hiểu biết sâu rộng về bán kính nguyên tử không chỉ giúp nâng cao kiến thức khoa học cơ bản mà còn mở ra những hướng đi mới trong các lĩnh vực ứng dụng, đóng góp vào sự phát triển khoa học công nghệ hiện đại. Việc khai thác và ứng dụng các yếu tố này sẽ tiếp tục mang lại những tiến bộ vượt bậc cho con người trong tương lai.











