Chủ đề hiệu ứng nhiệt đẳng tích: Hiệu ứng nhiệt đẳng tích là một khái niệm quan trọng trong nhiệt động lực học và hóa học, liên quan đến quá trình trao đổi nhiệt ở điều kiện thể tích không đổi. Bài viết này sẽ giúp bạn hiểu rõ hơn về nguyên lý, công thức tính toán và các ứng dụng thực tiễn của hiệu ứng nhiệt đẳng tích trong các lĩnh vực khoa học.
Mục lục
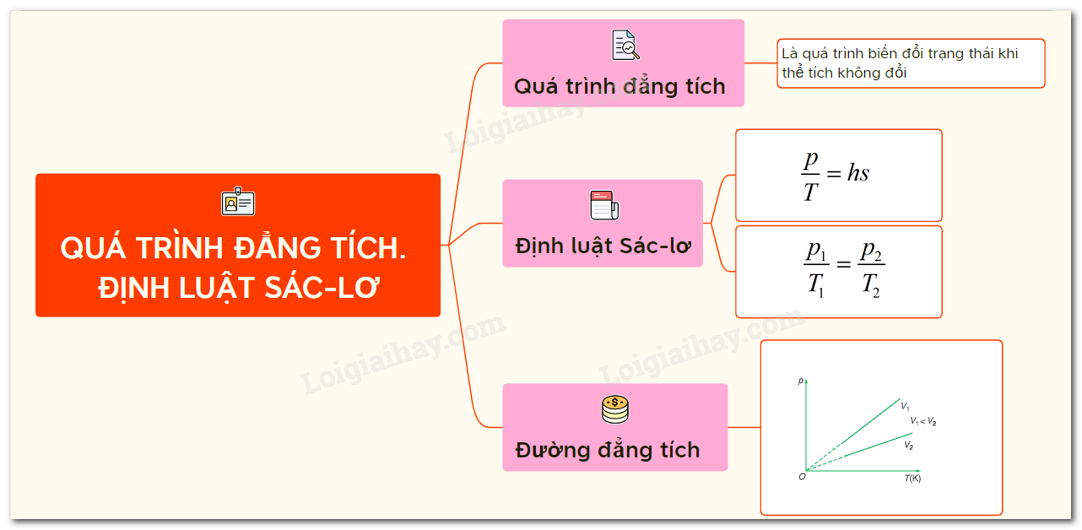
Hiệu Ứng Nhiệt Đẳng Tích
Hiệu ứng nhiệt đẳng tích là một khái niệm trong nhiệt động lực học và hóa học. Đây là quá trình trao đổi nhiệt xảy ra khi thể tích của hệ không thay đổi, tức là quá trình xảy ra trong điều kiện thể tích không đổi.
Định nghĩa và Công Thức
Trong một quá trình đẳng tích, công do hệ thực hiện bằng không (vì thể tích không đổi, không có công dãn nở). Nhiệt lượng cung cấp cho hệ sẽ làm thay đổi nội năng của hệ.
Công thức của hiệu ứng nhiệt đẳng tích là:
Trong đó:
Q_V là nhiệt lượng trong quá trình đẳng tíchΔU là sự thay đổi nội năng của hệ
Ứng Dụng Trong Hóa Học
Hiệu ứng nhiệt đẳng tích thường được sử dụng trong các bài toán nhiệt hóa học để tính toán nhiệt lượng trao đổi trong các phản ứng hóa học, đặc biệt là trong các hệ thống kín, nơi thể tích của hệ không thay đổi.
Các phương trình nhiệt hóa học có thể bao gồm hiệu ứng nhiệt để phản ánh sự thay đổi nội năng hoặc entanpi của hệ trong quá trình phản ứng. Những thay đổi này được mô tả bởi các phương trình nhiệt hóa học:
Tính Toán và Ví Dụ Minh Họa
Trong các bài tập thực hành, hiệu ứng nhiệt đẳng tích thường được tính toán dựa trên nhiệt lượng tỏa ra hoặc hấp thụ trong quá trình phản ứng hóa học. Ví dụ:
- Tính nhiệt lượng tỏa ra khi đốt cháy một chất trong một bình kín.
- Xác định sự thay đổi nội năng của hệ khi một phản ứng hóa học xảy ra trong điều kiện đẳng tích.
Kết Luận
Hiệu ứng nhiệt đẳng tích là một khái niệm cơ bản nhưng quan trọng trong nhiệt động lực học và hóa học, cung cấp cái nhìn sâu sắc về cách nhiệt lượng và năng lượng nội tại của hệ thống thay đổi trong điều kiện thể tích không đổi.

.png)
1. Giới thiệu về Hiệu Ứng Nhiệt Đẳng Tích
Hiệu ứng nhiệt đẳng tích là một khái niệm cơ bản trong lĩnh vực nhiệt động lực học, được sử dụng để mô tả quá trình trao đổi nhiệt khi thể tích của hệ không thay đổi. Trong quá trình này, nhiệt lượng cung cấp cho hệ không được sử dụng để làm tăng thể tích mà chỉ làm tăng nội năng của hệ.
Quá trình đẳng tích thường được phân tích trong các hệ thống khép kín, nơi thể tích được duy trì cố định. Điều này có nghĩa là bất kỳ nhiệt lượng nào được thêm vào hệ đều trực tiếp làm tăng nhiệt độ và nội năng của hệ, mà không làm thay đổi thể tích.
Một công thức quan trọng liên quan đến hiệu ứng nhiệt đẳng tích là:
Trong đó:
Q_V là nhiệt lượng trao đổi trong quá trình đẳng tích.ΔU là sự thay đổi nội năng của hệ.
Hiệu ứng nhiệt đẳng tích có ứng dụng quan trọng trong nhiều lĩnh vực, từ các nghiên cứu cơ bản về nhiệt động lực học cho đến các ứng dụng thực tế trong công nghiệp và khoa học vật liệu.
2. Nguyên lý và Công thức tính toán
Hiệu ứng nhiệt đẳng tích được mô tả qua nguyên lý cơ bản của nhiệt động lực học, trong đó quá trình diễn ra khi thể tích của hệ thống không thay đổi. Do không có sự thay đổi về thể tích, công thực hiện bởi hệ bằng không và toàn bộ nhiệt lượng trao đổi chỉ làm thay đổi nội năng của hệ.
Theo định luật thứ nhất của nhiệt động lực học, sự thay đổi nội năng
Công thức này thể hiện rằng khi nhiệt lượng
Để tính toán cụ thể hơn, nhiệt lượng
Trong đó:
n là số mol khí trong hệ.C_V là nhiệt dung mol đẳng tích của chất khí.ΔT là sự thay đổi nhiệt độ của hệ.
Công thức này cho thấy rằng nhiệt lượng trong quá trình đẳng tích phụ thuộc vào số mol khí, nhiệt dung đẳng tích và sự thay đổi nhiệt độ của hệ.
Nguyên lý và công thức tính toán hiệu ứng nhiệt đẳng tích đóng vai trò quan trọng trong các ứng dụng nhiệt động lực học và hóa học, giúp tính toán chính xác nhiệt lượng trao đổi trong các quá trình liên quan đến sự thay đổi nội năng mà không thay đổi thể tích.

3. Ứng dụng trong Hóa học và Vật lý
Hiệu ứng nhiệt đẳng tích có nhiều ứng dụng quan trọng trong cả hóa học và vật lý, đặc biệt trong việc nghiên cứu các quá trình nhiệt động lực học và phản ứng hóa học trong hệ kín.
3.1. Ứng dụng trong Hóa học
Trong hóa học, hiệu ứng nhiệt đẳng tích được sử dụng để tính toán nhiệt lượng trao đổi trong các phản ứng diễn ra trong hệ kín, nơi thể tích không thay đổi. Đây là trường hợp phổ biến khi nghiên cứu phản ứng hóa học trong các bình phản ứng kín hoặc trong quá trình lên men.
- Tính nhiệt lượng tỏa ra hoặc hấp thụ trong các phản ứng hóa học diễn ra trong bình kín.
- Xác định sự thay đổi nội năng của hệ phản ứng bằng cách sử dụng công thức
Q_V = ΔU .
3.2. Ứng dụng trong Vật lý
Trong vật lý, hiệu ứng nhiệt đẳng tích được áp dụng trong nghiên cứu động học của khí, đặc biệt là khi nghiên cứu quá trình gia nhiệt hoặc làm lạnh khí trong hệ kín.
- Phân tích các quá trình nhiệt trong máy móc và thiết bị công nghiệp, nơi các hệ thống kín thường được sử dụng để đảm bảo an toàn và hiệu quả.
- Nghiên cứu động học của khí lý tưởng và tính toán sự thay đổi nội năng trong quá trình đẳng tích.
Nhờ hiệu ứng nhiệt đẳng tích, các nhà khoa học và kỹ sư có thể hiểu rõ hơn về cách nhiệt lượng và năng lượng được chuyển hóa trong các quá trình nhiệt động lực học, từ đó tối ưu hóa hiệu suất và an toàn trong các ứng dụng thực tiễn.

4. Phân biệt với các quá trình nhiệt khác
Trong nhiệt động lực học, ngoài quá trình đẳng tích, còn có các quá trình nhiệt khác như đẳng áp, đẳng nhiệt và đoạn nhiệt. Mỗi quá trình này có các đặc điểm riêng biệt và ứng dụng cụ thể trong các lĩnh vực khoa học và kỹ thuật.
4.1. Quá trình đẳng áp
Quá trình đẳng áp là quá trình mà áp suất của hệ thống được giữ không đổi. Trong quá trình này, thể tích của hệ có thể thay đổi, và nhiệt lượng cung cấp cho hệ sẽ vừa làm thay đổi nội năng vừa thực hiện công.
- Công thức quan hệ:
Q_p = ΔU + PΔV - Ứng dụng: Sử dụng trong các bình nồi hơi, động cơ nhiệt, nơi áp suất được duy trì ổn định.
4.2. Quá trình đẳng nhiệt
Quá trình đẳng nhiệt là quá trình mà nhiệt độ của hệ thống được giữ không đổi. Đối với một hệ khí lý tưởng, nhiệt lượng cung cấp cho hệ sẽ hoàn toàn được sử dụng để thực hiện công, trong khi nội năng của hệ không thay đổi.
- Công thức quan hệ:
Q = W (nhiệt lượng bằng công thực hiện) - Ứng dụng: Ứng dụng trong các quá trình như nén khí, làm mát trong các hệ thống làm lạnh.
4.3. Quá trình đoạn nhiệt
Quá trình đoạn nhiệt là quá trình không có sự trao đổi nhiệt với môi trường. Nhiệt lượng trong quá trình này bằng 0, và sự thay đổi nội năng hoàn toàn do công thực hiện.
- Công thức quan hệ:
ΔU = -W - Ứng dụng: Được sử dụng trong các quá trình nhanh chóng như nổ, trong các động cơ nhiệt.
Hiệu ứng nhiệt đẳng tích khác biệt với các quá trình này ở chỗ nó giữ thể tích không đổi, do đó toàn bộ nhiệt lượng chỉ làm thay đổi nội năng của hệ mà không thực hiện công. Sự phân biệt giữa các quá trình này giúp xác định rõ cách thức nhiệt lượng và năng lượng được phân bố và sử dụng trong các hệ thống nhiệt động lực học khác nhau.

5. Ví dụ minh họa và bài tập liên quan
5.1. Ví dụ minh họa quá trình đẳng tích
Giả sử chúng ta có một lượng khí lý tưởng được chứa trong một bình kín, không thay đổi thể tích. Khi cung cấp một lượng nhiệt \(Q\) cho hệ, khí sẽ nóng lên, và nhiệt độ của nó tăng từ \(T_1\) đến \(T_2\). Quá trình này là một quá trình đẳng tích vì thể tích của khí không thay đổi.
Theo định luật khí lý tưởng, áp suất \(P\) của khí liên quan đến nhiệt độ \(T\) theo công thức:
\[
\frac{P_2}{P_1} = \frac{T_2}{T_1}
\]
Trong đó:
- \(P_1\) và \(P_2\) là áp suất của khí ở nhiệt độ \(T_1\) và \(T_2\).
- \(T_1\) và \(T_2\) là nhiệt độ ban đầu và nhiệt độ cuối cùng.
Ví dụ này minh họa sự thay đổi áp suất khi nhiệt độ tăng trong điều kiện đẳng tích.
5.2. Bài tập tính toán nhiệt lượng
Bài tập: Cho một lượng khí lý tưởng được chứa trong một bình kín có thể tích \(V = 10\) lít, ban đầu nhiệt độ là \(300\) K và áp suất là \(2\) atm. Tính nhiệt lượng \(Q\) cần thiết để tăng nhiệt độ của khí lên \(450\) K, biết rằng hệ số nhiệt dung riêng đẳng tích của khí là \(C_v = 20.8 \, \text{J/mol·K}\) và số mol khí \(n = 1\) mol.
Giải:
- Tính sự thay đổi nhiệt độ:
\[ \Delta T = T_2 - T_1 = 450\,\text{K} - 300\,\text{K} = 150\,\text{K} \]
- Tính nhiệt lượng cần thiết:
\[ Q = nC_v\Delta T = 1 \times 20.8 \times 150 = 3120\,\text{J} \]
Vậy nhiệt lượng cần thiết để tăng nhiệt độ của khí là \(3120\,\text{J}\).
XEM THÊM:
6. Kết luận về tầm quan trọng của Hiệu Ứng Nhiệt Đẳng Tích
Hiệu ứng nhiệt đẳng tích là một hiện tượng quan trọng trong lĩnh vực nhiệt động lực học, đặc biệt là trong các quá trình nhiệt liên quan đến sự thay đổi nội năng mà không thay đổi thể tích. Sự hiểu biết sâu sắc về hiệu ứng này giúp chúng ta có thể áp dụng các công thức và nguyên lý nhiệt động để phân tích và dự đoán các quá trình nhiệt trong thực tế.
Tầm quan trọng của hiệu ứng nhiệt đẳng tích nằm ở khả năng giải thích và dự đoán sự thay đổi của nội năng trong các hệ thống khép kín, khi không có sự thực hiện công cơ học. Điều này đặc biệt hữu ích trong việc nghiên cứu các phản ứng hóa học, trong đó sự biến đổi nhiệt lượng là một yếu tố quyết định đến cân bằng hóa học và hiệu suất phản ứng.
Ví dụ, trong một quá trình đẳng tích, toàn bộ nhiệt lượng được cung cấp cho hệ thống sẽ được sử dụng để tăng nội năng, thay vì làm giãn nở hệ thống. Điều này có nghĩa là, đối với các phản ứng hóa học trong điều kiện đẳng tích, nhiệt lượng hấp thụ hoặc tỏa ra hoàn toàn được thể hiện qua sự thay đổi nội năng của hệ thống, điều này có thể được tính toán và dự đoán chính xác.
Hơn nữa, việc hiểu rõ về hiệu ứng nhiệt đẳng tích còn giúp các nhà khoa học và kỹ sư tối ưu hóa các quá trình công nghiệp, từ việc chế tạo vật liệu đến việc thiết kế hệ thống nhiệt. Khả năng dự đoán chính xác nhiệt lượng cần thiết hoặc tỏa ra trong quá trình đẳng tích giúp tối ưu hóa năng lượng và cải thiện hiệu suất tổng thể.
Tóm lại, hiệu ứng nhiệt đẳng tích không chỉ là một hiện tượng lý thuyết mà còn có những ứng dụng thực tiễn quan trọng, đặc biệt trong nghiên cứu và phát triển các hệ thống nhiệt và phản ứng hóa học. Sự hiểu biết về hiệu ứng này đóng vai trò then chốt trong việc nâng cao hiệu quả năng lượng và phát triển công nghệ mới.