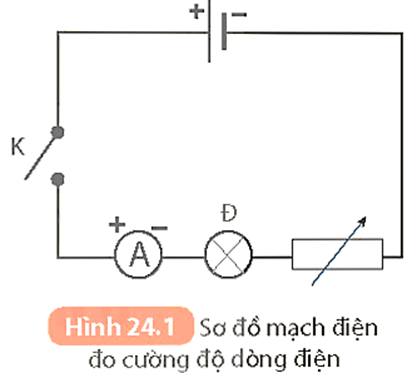
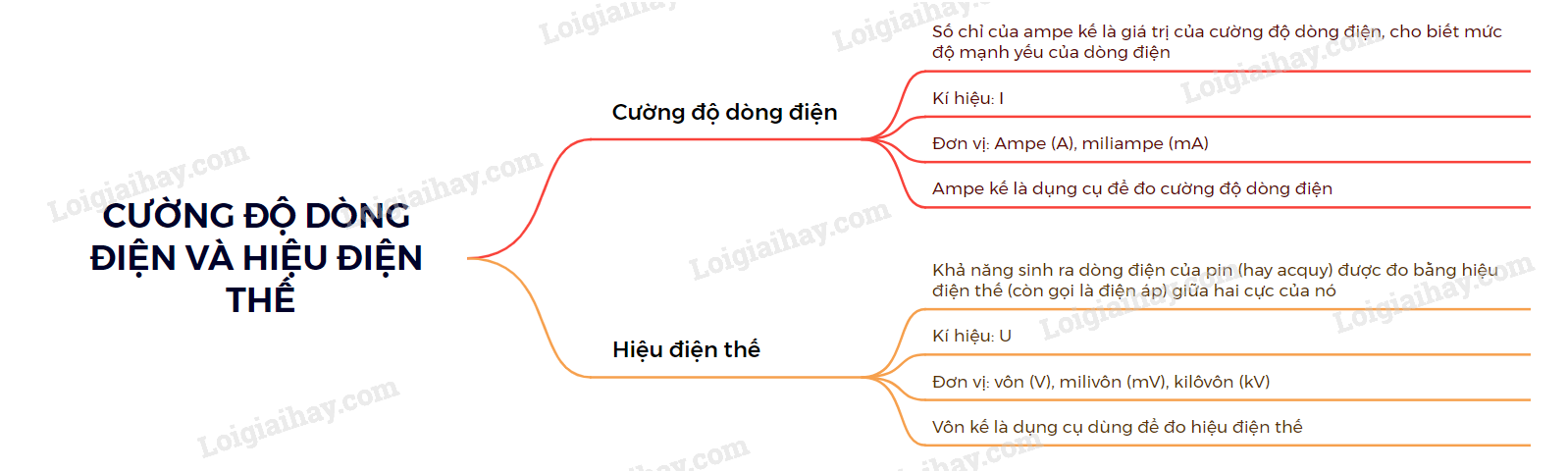
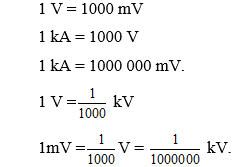Chủ đề hiệu điện thế giữa anot và catot: Hiệu điện thế giữa anot và catot là một khái niệm quan trọng trong điện học, đóng vai trò không thể thiếu trong các ứng dụng từ pin, đèn LED cho đến các thí nghiệm quang điện. Bài viết này sẽ giúp bạn hiểu rõ hơn về nguyên lý hoạt động và ứng dụng thực tiễn của hiệu điện thế giữa hai cực này trong đời sống.
Mục lục
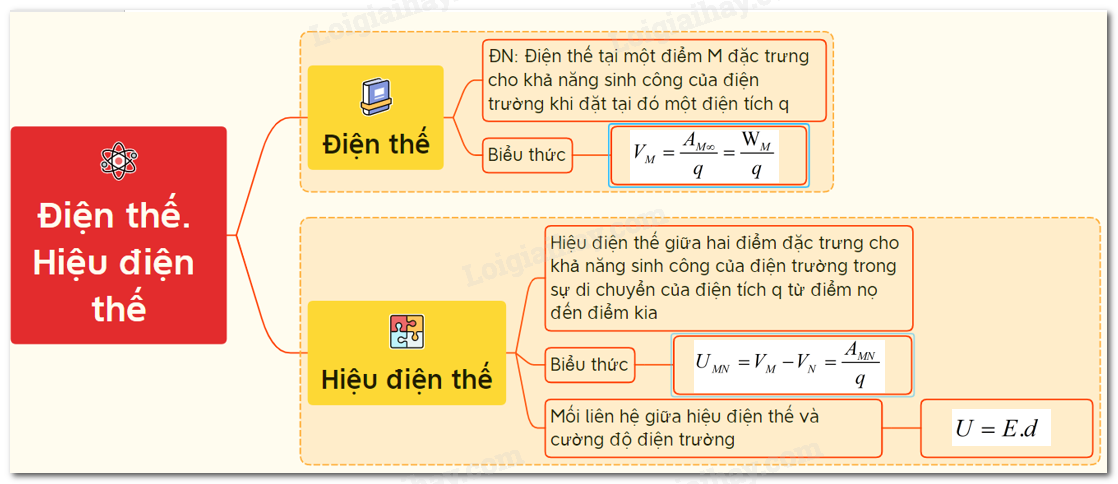
Hiệu Điện Thế Giữa Anot Và Catot
Hiệu điện thế giữa anot và catot là một khái niệm cơ bản trong điện học, thường được áp dụng trong các thiết bị điện tử và hệ thống điện hóa học. Hiểu rõ về khái niệm này giúp chúng ta nắm vững nguyên lý hoạt động của nhiều thiết bị quan trọng trong đời sống và công nghiệp.
1. Nguyên lý hoạt động
Anot là điện cực dương và catot là điện cực âm. Khi có một hiệu điện thế giữa hai cực này, các electron di chuyển từ catot sang anot, tạo thành dòng điện. Quá trình này diễn ra theo nguyên lý:
- Anot: Quá trình oxy hóa (mất electron) diễn ra tại anot.
- Catot: Quá trình khử (nhận electron) diễn ra tại catot.
Trong các thiết bị như ống chân không, pin, hoặc đèn LED, dòng electron giữa anot và catot là yếu tố quyết định để tạo ra dòng điện hoặc ánh sáng.
2. Công thức tính năng lượng động năng của electron
Khi một electron di chuyển từ catot đến anot, năng lượng động năng của nó được tính bằng công thức:
Trong đó:
- \(W_{\text{đ}}\): Năng lượng động năng của electron (Joules).
- \(e\): Điện tích của electron (\(1,6 \times 10^{-19}\) Coulombs).
- \(U\): Hiệu điện thế giữa anot và catot (Volts).
3. Ứng dụng thực tiễn
Hiệu điện thế giữa anot và catot được ứng dụng trong nhiều lĩnh vực, từ điện tử cho đến y học. Dưới đây là một số ứng dụng phổ biến:
- Ống chân không: Dùng trong các đèn điện tử và các hệ thống truyền tải điện.
- Pin và ắc quy: Sử dụng nguyên lý hiệu điện thế để tạo ra dòng điện liên tục cung cấp năng lượng cho các thiết bị điện tử.
- Đèn LED: Phát sáng thông qua quá trình phóng điện của các electron giữa anot và catot.
- Quang điện: Trong các tế bào quang điện, hiệu điện thế hãm giữa anot và catot được sử dụng để triệt tiêu dòng quang điện, tối ưu hóa hiệu suất của thiết bị.
4. Ví dụ cụ thể
Trong một ống Cu-lít-giơ, để tạo ra tia X, người ta đặt hiệu điện thế lớn giữa anot và catot. Các electron từ catot được gia tốc mạnh và khi va chạm vào anot, tạo ra tia X. Giá trị hiệu điện thế giữa anot và catot trong trường hợp này thường đạt tới hàng chục kV.
5. Phản ứng cân bằng trong tế bào điện
Trong các tế bào điện hóa học, phản ứng cân bằng giữa anot và catot diễn ra liên tục. Điện áp đặc trưng của mỗi nửa tế bào điện được gọi là thế năng khử, và quá trình oxy hóa khử diễn ra ở các điện cực. Khi tế bào đạt đến trạng thái cân bằng, dòng điện không còn được cung cấp thêm.
| Ứng dụng | Mô tả |
|---|---|
| Pin và ắc quy | Hiệu điện thế giữa anot và catot tạo ra dòng điện cho thiết bị. |
| Đèn LED | Electron di chuyển giữa anot và catot phát ra ánh sáng. |
| Ống chân không | Điện tử học cơ bản và truyền tải điện qua dòng electron. |
.png)
1. Khái niệm Anot và Catot
Anot và catot là hai điện cực quan trọng trong các quá trình điện hóa và điện tử. Chúng ta sẽ khám phá chi tiết về khái niệm, đặc điểm và sự khác biệt giữa hai điện cực này.
1.1. Anot là gì?
Anot là điện cực mà tại đó quá trình oxy hóa xảy ra, tức là nơi các electron bị mất đi. Trong các quá trình điện hóa, anot thường được gọi là cực dương vì nó có điện thế dương so với môi trường xung quanh. Trong một tế bào điện phân, anot hút các ion âm từ dung dịch.
Ví dụ: Trong một tế bào điện phân, nếu chúng ta điện phân dung dịch NaCl, thì tại anot sẽ xảy ra quá trình oxy hóa ion Cl⁻ thành Cl₂.
1.2. Catot là gì?
Catot là điện cực nơi quá trình khử xảy ra, tức là nơi các electron được nhận vào. Catot được gọi là cực âm vì nó có điện thế âm so với môi trường xung quanh trong quá trình điện phân. Trong một tế bào điện hóa, catot hút các ion dương từ dung dịch.
Ví dụ: Trong một pin điện hóa, các ion kim loại sẽ di chuyển tới catot để nhận electron và tạo thành kim loại nguyên chất.
1.3. Sự khác biệt giữa Anot và Catot
- Anot: Là nơi xảy ra quá trình oxy hóa (mất electron), có điện thế dương.
- Catot: Là nơi xảy ra quá trình khử (nhận electron), có điện thế âm.
Quá trình này có thể được mô tả bằng các phương trình hóa học đơn giản:
1.4. Vai trò trong tế bào điện hóa và điện phân
- Tế bào điện hóa: Anot là nơi xảy ra quá trình oxy hóa và catot là nơi xảy ra quá trình khử.
- Tế bào điện phân: Dòng điện được cung cấp từ bên ngoài để thúc đẩy các phản ứng tại anot và catot.
Sự khác biệt và vai trò của anot và catot trong các quá trình này không chỉ phụ thuộc vào loại tế bào mà còn vào môi trường điện hóa cụ thể.
2. Hiệu điện thế giữa Anot và Catot
Hiệu điện thế giữa anot và catot là một đại lượng vật lý quan trọng trong các hệ thống điện hóa, pin và mạch điện tử. Hiệu điện thế này đại diện cho sự chênh lệch năng lượng giữa hai điện cực, từ đó tạo ra dòng điện khi có sự dịch chuyển electron giữa anot và catot.
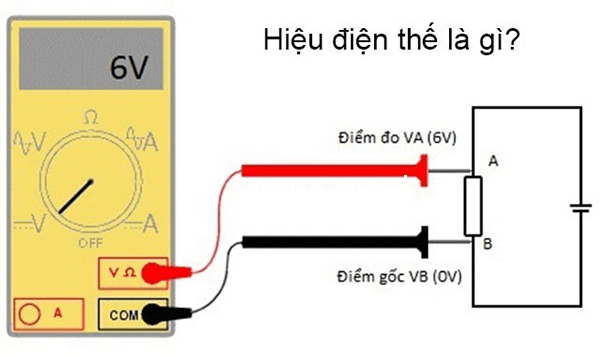
2.1. Khái niệm hiệu điện thế
Hiệu điện thế, hay còn gọi là điện áp, là sự chênh lệch điện thế giữa hai điểm trong một mạch điện. Trong hệ thống điện hóa, hiệu điện thế giữa anot và catot quyết định khả năng của electron di chuyển từ catot (cực âm) sang anot (cực dương).
Hiệu điện thế giữa anot và catot có thể được tính bằng công thức:
Trong đó:
- \(U\): Hiệu điện thế (Volt).
- \(V_{\text{anot}}\): Điện thế tại anot (Volt).
- \(V_{\text{catot}}\): Điện thế tại catot (Volt).
2.2. Quá trình tạo dòng điện giữa Anot và Catot
Khi hiệu điện thế giữa anot và catot được thiết lập, các electron bắt đầu di chuyển từ catot sang anot. Điều này tạo ra một dòng điện qua mạch ngoài. Dòng điện càng lớn khi hiệu điện thế càng cao.
- Anot: Điện cực dương, nhận electron.
- Catot: Điện cực âm, phát electron.
Quá trình này là nguyên tắc hoạt động của các thiết bị như pin, ống chân không và nhiều thiết bị điện tử khác.
2.3. Công thức năng lượng liên quan đến hiệu điện thế
Năng lượng của electron di chuyển từ catot đến anot được xác định bởi công thức:
Trong đó:
- \(W\): Năng lượng (Joules).
- \(e\): Điện tích của electron (\(1.6 \times 10^{-19}\) Coulombs).
- \(U\): Hiệu điện thế giữa anot và catot (Volts).
2.4. Ứng dụng của hiệu điện thế giữa Anot và Catot
Hiệu điện thế giữa anot và catot được ứng dụng rộng rãi trong các lĩnh vực khác nhau:
- Pin và ắc quy: Hiệu điện thế cung cấp năng lượng cho các thiết bị điện tử.
- Đèn LED: Phát sáng khi có dòng điện chạy giữa anot và catot.
- Ống chân không: Dòng electron di chuyển qua chân không giữa anot và catot, tạo ra các hiện tượng điện tử.
- Tia X: Hiệu điện thế cao giữa anot và catot tạo ra tia X trong các thiết bị y tế.
2.5. Ví dụ về hiệu điện thế trong thực tế
Một ví dụ điển hình về hiệu điện thế giữa anot và catot là trong ống Cu-lít-giơ, nơi các electron từ catot được gia tốc bởi hiệu điện thế rất cao và va chạm với anot để tạo ra tia X. Giá trị hiệu điện thế trong trường hợp này có thể lên đến hàng chục kV.

3. Ứng dụng của hiệu điện thế giữa Anot và Catot
Hiệu điện thế giữa anot và catot đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ. Các ứng dụng này trải dài từ pin và ắc quy cho đến các thiết bị chiếu sáng và thậm chí là thiết bị y tế. Dưới đây là một số ứng dụng phổ biến của hiệu điện thế giữa hai điện cực này.
3.1. Ứng dụng trong Pin và Ắc Quy
Trong pin và ắc quy, hiệu điện thế giữa anot và catot tạo ra dòng điện cung cấp năng lượng cho các thiết bị điện tử. Ví dụ, trong pin Lithium-ion, anot thường là than chì còn catot là hợp chất oxit kim loại. Hiệu điện thế giữa hai cực này có thể đạt từ 3V đến 4V, tạo ra dòng điện liên tục khi pin được sử dụng.
3.2. Ứng dụng trong Đèn LED
Đèn LED hoạt động dựa trên nguyên lý của diode bán dẫn, trong đó hiệu điện thế giữa anot và catot tạo ra ánh sáng khi electron di chuyển từ catot sang anot. Khi electron di chuyển qua lớp tiếp giáp giữa hai chất bán dẫn, chúng phát ra năng lượng dưới dạng ánh sáng, tùy thuộc vào vật liệu sử dụng mà màu sắc và cường độ ánh sáng sẽ khác nhau.
3.3. Ứng dụng trong Ống Chân Không và Tia X
Trong ống chân không và thiết bị phát tia X, hiệu điện thế giữa anot và catot có thể rất cao, thường lên đến hàng chục nghìn volt (kV). Các electron từ catot được gia tốc bởi hiệu điện thế này và va chạm vào anot, tạo ra bức xạ X, được sử dụng trong y tế để chụp hình ảnh bên trong cơ thể con người.
3.4. Ứng dụng trong Các Tế Bào Quang Điện
Trong các tế bào quang điện (solar cells), hiệu điện thế giữa anot và catot được tạo ra khi ánh sáng mặt trời chiếu vào bề mặt chất bán dẫn. Quá trình này kích thích các electron di chuyển từ catot sang anot, tạo ra dòng điện một chiều (DC), cung cấp năng lượng sạch cho các thiết bị điện.
3.5. Ứng dụng trong Mạ Điện và Lọc Điện
Hiệu điện thế giữa anot và catot cũng được ứng dụng trong quá trình mạ điện, nơi các ion kim loại từ dung dịch điện phân được hút về catot và bám lên bề mặt vật liệu, tạo ra lớp mạ bảo vệ hoặc trang trí. Tương tự, quá trình lọc điện sử dụng hiệu điện thế để tách các chất không mong muốn ra khỏi dung dịch.
3.6. Ứng dụng trong Thiết Bị Lưu Trữ Năng Lượng
Hiệu điện thế giữa anot và catot được tận dụng trong các thiết bị lưu trữ năng lượng như siêu tụ điện và pin nhiên liệu. Các thiết bị này sử dụng sự chênh lệch điện thế để lưu trữ và giải phóng năng lượng hiệu quả, cung cấp năng lượng cho các hệ thống công nghiệp và dân dụng.
Các ứng dụng của hiệu điện thế giữa anot và catot cho thấy tầm quan trọng của nó trong việc phát triển công nghệ hiện đại, từ các thiết bị gia dụng nhỏ đến các hệ thống phức tạp trong công nghiệp và y tế.

4. Phản ứng oxy hóa và khử giữa Anot và Catot
Phản ứng oxy hóa và khử giữa anot và catot là cốt lõi của nhiều quá trình điện hóa, từ hoạt động của pin đến các quá trình điện phân. Phản ứng này diễn ra tại hai điện cực và quyết định dòng điện cũng như sản phẩm tạo ra từ quá trình điện hóa.
4.1. Phản ứng oxy hóa tại Anot
Tại anot, quá trình oxy hóa xảy ra, tức là các ion hoặc nguyên tử mất electron và trở thành dạng oxy hóa. Anot thường được gọi là điện cực dương trong các hệ thống điện phân, và là nơi diễn ra sự mất electron.
- Phương trình tổng quát của quá trình oxy hóa:
Ví dụ, trong quá trình điện phân nước, tại anot, ion hydroxide (OH⁻) bị oxy hóa thành oxy (O₂) và nước:
4.2. Phản ứng khử tại Catot
Ngược lại với anot, tại catot diễn ra quá trình khử, nơi các ion hoặc nguyên tử nhận electron và chuyển sang trạng thái khử. Catot là điện cực âm trong điện phân, và nó cung cấp electron cho phản ứng khử.
- Phương trình tổng quát của quá trình khử:
Ví dụ, trong quá trình điện phân dung dịch đồng sunfat (CuSO₄), tại catot, ion đồng (Cu²⁺) nhận electron và bị khử thành kim loại đồng (Cu):
4.3. Tương tác giữa Anot và Catot trong quá trình điện hóa
Trong quá trình điện hóa, sự tương tác giữa anot và catot tạo nên một mạch khép kín, với dòng electron di chuyển từ catot qua mạch ngoài đến anot. Quá trình này dẫn đến các phản ứng oxy hóa khử tại hai cực, từ đó tạo ra dòng điện hoặc các sản phẩm hóa học mong muốn.
4.4. Ứng dụng của phản ứng oxy hóa khử trong thực tế
- Pin: Trong các pin điện hóa, phản ứng oxy hóa xảy ra tại anot và phản ứng khử xảy ra tại catot, tạo ra dòng điện cung cấp năng lượng cho các thiết bị điện tử.
- Điện phân: Quá trình điện phân nước hoặc các dung dịch muối dùng để tách các nguyên tố hoặc tạo ra các chất mới.
- Mạ điện: Các ion kim loại trong dung dịch điện phân bị khử tại catot, tạo thành lớp mạ kim loại trên bề mặt vật liệu.
Các phản ứng oxy hóa và khử giữa anot và catot đóng vai trò thiết yếu trong nhiều công nghệ hiện đại, từ lưu trữ năng lượng đến sản xuất các vật liệu mới, góp phần không nhỏ vào sự phát triển của các ngành công nghiệp.

5. Thí nghiệm và ví dụ cụ thể
Thí nghiệm đo hiệu điện thế giữa anot và catot là một trong những bài thực hành phổ biến trong hóa học và vật lý điện hóa. Dưới đây là một ví dụ cụ thể về thí nghiệm đo hiệu điện thế sử dụng pin điện hóa.
5.1. Thí nghiệm đo hiệu điện thế giữa Anot và Catot trong pin Daniell
Pin Daniell là một ví dụ đơn giản và dễ thực hiện để minh họa sự khác biệt về hiệu điện thế giữa anot và catot. Pin này gồm hai nửa tế bào: một nửa chứa dung dịch CuSO₄ với catot bằng đồng, và nửa còn lại chứa dung dịch ZnSO₄ với anot bằng kẽm. Chúng ta sử dụng cầu muối để kết nối hai nửa tế bào và đo hiệu điện thế giữa hai điện cực.
5.1.1. Dụng cụ và hóa chất
- Dung dịch CuSO₄ 1M
- Dung dịch ZnSO₄ 1M
- Tấm kẽm (Zn)
- Tấm đồng (Cu)
- Cầu muối
- Vôn kế
- Dây dẫn điện
- Cốc thủy tinh
5.1.2. Quy trình thí nghiệm
- Chuẩn bị hai cốc thủy tinh, một chứa dung dịch CuSO₄ và một chứa dung dịch ZnSO₄.
- Đặt tấm đồng vào dung dịch CuSO₄ và tấm kẽm vào dung dịch ZnSO₄.
- Kết nối hai cốc thủy tinh bằng cầu muối để hoàn thiện mạch điện.
- Kết nối tấm kẽm (anot) và tấm đồng (catot) với vôn kế bằng dây dẫn điện.
- Quan sát số chỉ trên vôn kế để đo hiệu điện thế giữa anot và catot.
Trong thí nghiệm này, bạn sẽ thấy hiệu điện thế giữa hai điện cực xuất hiện trên vôn kế. Hiệu điện thế này là kết quả của sự chênh lệch năng lượng giữa phản ứng oxy hóa tại anot và phản ứng khử tại catot. Đối với pin Daniell, hiệu điện thế thường vào khoảng 1.1V.
5.2. Ví dụ cụ thể về ứng dụng thực tiễn
Một ví dụ cụ thể về việc sử dụng hiệu điện thế giữa anot và catot là trong hệ thống sạc pin của các thiết bị điện tử như điện thoại di động. Khi sạc pin, một hiệu điện thế được áp dụng giữa anot và catot của pin Lithium-ion, thúc đẩy quá trình oxy hóa và khử trong pin, từ đó lưu trữ năng lượng cho thiết bị.
5.2.1. Pin Lithium-ion
- Anot: Thường là than chì (graphite).
- Catot: Là hợp chất oxit kim loại, ví dụ như LiCoO₂.
- Hiệu điện thế: Thường khoảng 3.7V.
Quá trình này xảy ra theo nguyên tắc tương tự như thí nghiệm với pin Daniell, nhưng ở quy mô nhỏ hơn và trong các điều kiện tiên tiến hơn, giúp lưu trữ năng lượng hiệu quả hơn cho các thiết bị điện tử hiện đại.