Chủ đề điện tích của ion na+: Điện tích của ion Na+ là một khái niệm quan trọng trong hóa học, đóng vai trò thiết yếu trong nhiều phản ứng hóa học và ứng dụng thực tế. Bài viết này sẽ giúp bạn hiểu rõ về cấu tạo, tính chất, và ứng dụng của ion Na+ trong đời sống và công nghiệp.
Mục lục
Điện Tích Của Ion Na+
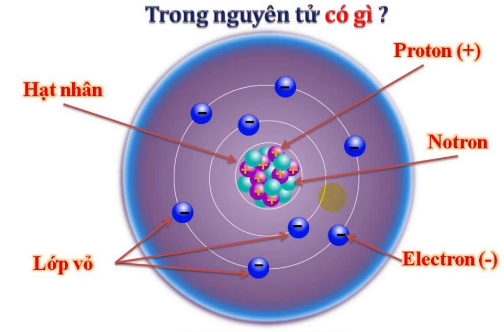
Ion Na+ (natri dương) là một ion đơn nguyên tử, được tạo ra khi nguyên tử natri (Na) mất đi một electron để đạt đến cấu hình electron bền vững của khí hiếm. Quá trình này làm cho ion Na+ mang điện tích dương với giá trị là +1. Điện tích dương này được xác định dựa trên sự mất mát của một electron từ lớp vỏ ngoài cùng của nguyên tử natri.
Quá Trình Hình Thành Ion Na+
- Nguyên tử natri có cấu hình electron: .
- Khi mất đi 1 electron, nguyên tử Na trở thành ion Na+ với cấu hình electron mới: , tương ứng với cấu hình electron của khí hiếm neon (Ne).
- Điện tích của ion Na+ là +1 do sự mất mát 1 electron mang điện tích âm.
Tính Chất Của Ion Na+
- Ion Na+ có khả năng kết hợp với các ion âm như Cl- để tạo thành các hợp chất ion, ví dụ: NaCl (muối ăn).
- Các hợp chất chứa ion Na+ thường có tính chất bền vững, điểm nóng chảy cao và tồn tại dưới dạng tinh thể trong điều kiện rắn.
- Trong dung dịch, ion Na+ dễ dàng hòa tan và trở thành một phần của dung dịch điện giải, đóng vai trò quan trọng trong cân bằng điện giải của cơ thể sinh vật.
Ứng Dụng Của Ion Na+
- Trong sinh học: Ion Na+ rất quan trọng trong các quá trình sinh lý như truyền xung thần kinh, cân bằng nước và áp suất thẩm thấu trong cơ thể.
- Trong công nghiệp: Ion Na+ được sử dụng trong quá trình điện phân để sản xuất natri kim loại và các hợp chất natri khác.
- Trong y học: Na+ là thành phần chủ yếu trong các dung dịch truyền dịch để duy trì cân bằng điện giải cho bệnh nhân.
Kết Luận
Ion Na+ đóng vai trò cực kỳ quan trọng không chỉ trong hóa học mà còn trong nhiều lĩnh vực khác nhau của đời sống. Với điện tích +1, nó tham gia vào nhiều quá trình quan trọng, từ việc hình thành các hợp chất cơ bản như muối ăn đến việc duy trì hoạt động sinh lý bình thường của cơ thể con người.

.png)
1. Khái Niệm Về Ion Na+
Ion Na+ là một ion đơn nguyên tử được tạo ra khi nguyên tử natri (Na) mất đi một electron. Quá trình này xảy ra để nguyên tử natri đạt được cấu hình electron bền vững, tương tự như cấu hình của các khí hiếm. Khi mất đi một electron, ion Na+ mang điện tích dương với giá trị +1.
- Nguyên tử natri ban đầu có cấu hình electron: .
- Quá trình ion hóa xảy ra khi nguyên tử natri mất đi electron 3s1 để tạo thành ion Na+.
- Cấu hình electron của ion Na+ sau khi mất electron: , tương ứng với cấu hình của khí hiếm neon (Ne).
Ion Na+ thường tồn tại trong các hợp chất ion, như NaCl (muối ăn), và đóng vai trò quan trọng trong nhiều phản ứng hóa học. Với điện tích +1, ion Na+ tạo nên liên kết ion mạnh với các ion âm, đặc biệt là Cl-, để hình thành các tinh thể bền vững và có độ tan cao trong nước.
2. Quá Trình Hình Thành Ion Na+
Quá trình hình thành ion Na+ bắt đầu khi nguyên tử natri (Na) mất đi một electron để đạt được cấu hình electron ổn định, giống như các khí hiếm. Quá trình này có thể được hiểu theo các bước cụ thể sau:
- Nguyên tử natri ban đầu có một electron ở lớp vỏ ngoài cùng, có cấu hình electron: . Electron 3s1 này có mức năng lượng cao hơn và dễ bị loại bỏ.
- Thông qua quá trình ion hóa, nguyên tử natri mất electron 3s1 của mình, dẫn đến việc hình thành ion Na+ có điện tích +1. Điều này xảy ra vì khi mất đi một electron âm, nguyên tử natri trở thành một ion mang điện tích dương.
- Sau khi mất electron, cấu hình electron của ion Na+ trở thành: , giống với cấu hình electron bền vững của khí hiếm neon (Ne).
Ion Na+ hình thành có vai trò quan trọng trong nhiều hợp chất hóa học, đặc biệt là trong các liên kết ion với các anion như Cl-. Liên kết ion này giúp hình thành các cấu trúc tinh thể bền vững như NaCl, thường được biết đến dưới tên gọi muối ăn.

3. Điện Tích Của Ion Na+
Điện tích của ion Na+ là một trong những đặc điểm quan trọng giúp xác định tính chất hóa học và vật lý của nó. Ion Na+ hình thành khi nguyên tử natri (Na) mất đi một electron, do đó, điện tích của nó trở thành +1. Quá trình này được biểu diễn bằng phương trình:
- Ion Na+ có điện tích +1 vì mất đi một electron âm, tạo nên sự mất cân bằng giữa số proton và electron trong nguyên tử.
- Điện tích +1 của ion Na+ đóng vai trò quan trọng trong việc tạo liên kết ion với các ion âm khác, chẳng hạn như Cl-, để hình thành các hợp chất bền vững.
- Điện tích dương này cũng ảnh hưởng đến tính chất hóa học của ion Na+, bao gồm khả năng hòa tan trong nước và tham gia vào các phản ứng hóa học khác.
Nhờ điện tích +1, ion Na+ có khả năng tương tác mạnh với nước và các phân tử khác, tạo nên các hợp chất ion có vai trò quan trọng trong các quá trình sinh hóa và công nghiệp.

XEM THÊM:
4. Tính Chất Hóa Học Của Ion Na+
Ion Na+ là một cation mang điện tích dương (+1) được hình thành khi nguyên tử natri mất đi một electron. Tính chất hóa học của ion Na+ chịu ảnh hưởng lớn từ điện tích dương này, điều này tạo ra một số đặc điểm quan trọng:
- Khả năng tạo liên kết ion: Do có điện tích dương, ion Na+ dễ dàng tạo liên kết với các ion âm như Cl- để hình thành các hợp chất ion, ví dụ như muối ăn (NaCl).
- Khả năng hòa tan trong nước: Ion Na+ rất dễ hòa tan trong nước, tạo ra dung dịch điện ly mạnh. Điều này là do Na+ có khả năng tương tác mạnh với phân tử nước, dẫn đến quá trình hydrat hóa.
- Phản ứng hóa học: Ion Na+ thường tham gia vào các phản ứng trao đổi ion, đặc biệt là trong môi trường nước. Nó cũng có thể phản ứng với các axit và bazơ để tạo ra muối và nước.
- Vai trò sinh học: Na+ là một trong những ion cần thiết cho các quá trình sinh học, như duy trì áp suất thẩm thấu và truyền tín hiệu thần kinh trong cơ thể người.
Tính chất hóa học của ion Na+ làm cho nó trở thành một trong những cation quan trọng và phổ biến nhất trong cả hóa học vô cơ lẫn hóa học sinh học.

5. Ứng Dụng Của Ion Na+
Ion Na+ có rất nhiều ứng dụng quan trọng trong cả lĩnh vực hóa học và sinh học. Dưới đây là một số ứng dụng nổi bật:
- Sản xuất muối ăn: Ion Na+ kết hợp với ion Cl- để tạo ra NaCl, hay muối ăn, là một sản phẩm thiết yếu trong đời sống hàng ngày.
- Xử lý nước: Na+ được sử dụng trong quá trình làm mềm nước, nơi nó thay thế các ion canxi và magiê trong nước cứng để ngăn chặn sự hình thành cặn.
- Trong y học: Ion Na+ là thành phần chính trong các dung dịch truyền tĩnh mạch như dung dịch muối sinh lý, giúp duy trì cân bằng điện giải trong cơ thể.
- Sản xuất xà phòng: Na+ là một thành phần quan trọng trong quá trình xà phòng hóa, giúp tạo ra xà phòng từ dầu mỡ và kiềm.
- Điện hóa: Ion Na+ đóng vai trò quan trọng trong pin natri-ion, một loại pin tiềm năng trong tương lai để thay thế cho pin lithium-ion.
Với các ứng dụng đa dạng này, ion Na+ là một trong những ion quan trọng và được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau.
6. Tinh Thể Ion Và NaCl
Tinh thể NaCl, hay còn gọi là muối ăn, là một trong những ví dụ điển hình nhất của cấu trúc tinh thể ion. Trong cấu trúc này, các ion Na+ và Cl- được sắp xếp xen kẽ nhau theo một trật tự cố định, tạo thành một mạng lưới ba chiều vô cùng ổn định.
6.1. Cấu trúc tinh thể NaCl
Tinh thể NaCl có cấu trúc lập phương tâm mặt (Face-Centered Cubic - FCC), trong đó mỗi ion Na+ được bao quanh bởi sáu ion Cl- và ngược lại. Độ dài cạnh của ô mạng lập phương đơn vị của NaCl là khoảng 0,564 nm. Điều này giúp xác định kích thước và hình dạng của ô mạng, tạo nên tính chất vật lý đặc trưng của NaCl như độ cứng, độ bền và điểm nóng chảy cao.
6.2. Sự hình thành và tính chất của tinh thể NaCl
Liên kết ion trong NaCl được hình thành do sự chuyển electron từ nguyên tử Na sang nguyên tử Cl, dẫn đến việc hình thành ion Na+ và Cl-. Các ion này sau đó bị hút nhau mạnh mẽ nhờ lực tĩnh điện, tạo nên một cấu trúc tinh thể rắn chắc và bền vững.
Tinh thể NaCl có nhiều tính chất vật lý đáng chú ý, bao gồm:
- Độ tan: NaCl tan rất tốt trong nước, tạo ra các dung dịch có khả năng dẫn điện mạnh.
- Điểm nóng chảy: Tinh thể NaCl có điểm nóng chảy cao, khoảng 801°C, cho thấy liên kết ion rất mạnh mẽ.
- Độ cứng: Trên thang độ cứng Mohs, NaCl đạt mức 2-2.5, thể hiện sự ổn định của cấu trúc tinh thể.
- Màu sắc: Tinh thể NaCl thường có màu trắng trong suốt, phản xạ ánh sáng tốt.
Nhờ vào các tính chất này, NaCl không chỉ đóng vai trò quan trọng trong đời sống hàng ngày mà còn có nhiều ứng dụng trong công nghiệp và y học, đặc biệt là trong các quy trình điện phân và sản xuất hóa chất.