Chủ đề công thức tính số nguyên tử lớp 10: Bài viết này sẽ hướng dẫn chi tiết cách tính số nguyên tử trong hóa học lớp 10, cung cấp công thức dễ hiểu cùng các ví dụ minh họa và bài tập thực hành. Học sinh sẽ nắm vững kiến thức về số nguyên tử và ứng dụng trong các bài toán hóa học thông qua các bước giải bài cụ thể.
Mục lục
- Công Thức Tính Số Nguyên Tử - Hóa Học Lớp 10
- 1. Tổng quan về số mol và số nguyên tử
- 2. Các dạng bài tập về tính số nguyên tử
- 3. Mối liên hệ giữa số nguyên tử và các chủ đề Hóa học khác
- 4. Tổng hợp các công thức Hóa học lớp 10 liên quan
- 5. Các bài tập có lời giải chi tiết
- 6. Lời kết và một số lưu ý khi làm bài tập về số nguyên tử
Công Thức Tính Số Nguyên Tử - Hóa Học Lớp 10
Trong chương trình hóa học lớp 10, việc tính số nguyên tử là một phần quan trọng giúp học sinh nắm vững kiến thức cơ bản về cấu tạo chất. Để tính toán số nguyên tử trong một lượng chất nhất định, ta cần sử dụng khái niệm số mol và hằng số Avogadro.
1. Công thức tính số nguyên tử
Công thức tổng quát để tính số nguyên tử \(N\) trong một lượng chất dựa trên số mol \(n\) của chất đó:
\[
N = n \times N_A
\]
Trong đó:
- \(N\) là số nguyên tử cần tính
- \(n\) là số mol của chất
- \(N_A\) là hằng số Avogadro, có giá trị xấp xỉ \(6.022 \times 10^{23}\) nguyên tử/mol
2. Ví dụ tính toán
Ví dụ: Tính số nguyên tử của một lượng \(0.5\) mol nhôm (Al).
Áp dụng công thức:
\[
N = 0.5 \times 6.022 \times 10^{23} = 3.011 \times 10^{23}
\]
Vậy trong \(0.5\) mol nhôm có \(3.011 \times 10^{23}\) nguyên tử nhôm.
3. Luyện tập bài tập tính số nguyên tử
Các bài tập luyện tập thường yêu cầu học sinh tính số nguyên tử dựa trên số mol của một nguyên tố hoặc hợp chất đã cho. Sau đây là một số dạng bài tập phổ biến:
- Tính số nguyên tử trong một số mol nhất định của một nguyên tố (ví dụ: \(2\) mol cacbon \(C\))
- Tính số mol khi biết số nguyên tử (ví dụ: \(3 \times 10^{23}\) nguyên tử)
- Ứng dụng công thức trong các bài toán hóa học phức tạp hơn
4. Các khái niệm liên quan
- Số Avogadro: Là số hạt cơ bản (nguyên tử, phân tử, ion, ...) có trong một mol chất. Giá trị của nó là \(6.022 \times 10^{23}\).
- Mol: Là đơn vị đo lượng chất trong hóa học, tương đương với số lượng hạt có trong số Avogadro của chất đó.
5. Kết luận
Việc hiểu và áp dụng công thức tính số nguyên tử không chỉ giúp học sinh giải quyết các bài tập về lượng chất mà còn là nền tảng quan trọng cho các kiến thức hóa học ở các lớp cao hơn. Học sinh nên thực hành nhiều bài tập để nắm vững công thức và cách áp dụng vào các bài toán thực tế.
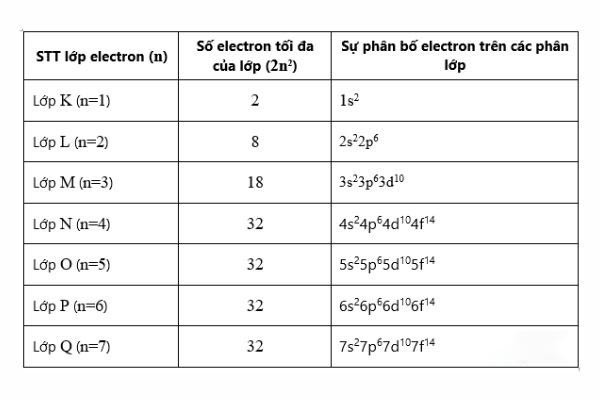
.png)
1. Tổng quan về số mol và số nguyên tử
Số mol và số nguyên tử là những khái niệm cơ bản trong hóa học lớp 10, giúp học sinh hiểu sâu hơn về cấu tạo vi mô của các chất. Dưới đây là tổng quan về các khái niệm này cùng với cách tính toán cơ bản.
Số mol là gì?
Số mol (ký hiệu là \( n \)) là đơn vị đo lượng chất trong hóa học, tương ứng với lượng chất chứa cùng số lượng hạt (nguyên tử, phân tử, ion) như số nguyên tử có trong 12 gram đồng vị carbon-12. Giá trị này được gọi là hằng số Avogadro, với:
- \( 1 \, mol \approx 6,022 \times 10^{23} \) hạt
Công thức tính số mol
Công thức tính số mol dựa trên khối lượng chất:
- \( n = \frac{m}{M} \)
Trong đó:
- \( n \): số mol
- \( m \): khối lượng chất (g)
- \( M \): khối lượng mol (g/mol)
Số nguyên tử là gì?
Số nguyên tử trong một lượng chất có thể được tính dựa vào số mol và hằng số Avogadro. Nếu biết số mol của chất, ta có thể tính số nguyên tử bằng công thức:
- Số nguyên tử = Số mol × \( 6,022 \times 10^{23} \)
Ví dụ minh họa
Giả sử chúng ta có 2 mol nguyên tử oxy (O). Từ công thức trên, số nguyên tử của oxy sẽ là:
- Số nguyên tử = \( 2 \times 6,022 \times 10^{23} \approx 1,204 \times 10^{24} \) nguyên tử
Ứng dụng của số mol và số nguyên tử
Hiểu rõ số mol và số nguyên tử giúp học sinh giải quyết các bài tập liên quan đến tính toán lượng chất trong các phản ứng hóa học, cũng như hiểu sâu hơn về thành phần cấu tạo của các chất trong tự nhiên.
2. Các dạng bài tập về tính số nguyên tử
Trong quá trình học Hóa học lớp 10, việc nắm vững cách tính số nguyên tử là rất quan trọng. Dưới đây là các dạng bài tập phổ biến liên quan đến tính số nguyên tử cùng với phương pháp giải.
Dạng 1: Tính số nguyên tử từ số mol
Đây là dạng bài tập cơ bản nhất, yêu cầu học sinh tính số nguyên tử dựa trên số mol đã cho. Công thức được sử dụng là:
Trong đó:
- A là số nguyên tử
- n là số mol
- N = \(6.022 \times 10^{23}\) là hằng số Avogadro
Dạng 2: Tính số mol từ số nguyên tử
Dạng bài này yêu cầu tính ngược lại từ số nguyên tử đã cho, học sinh cần tính ra số mol. Công thức áp dụng là:
Trong đó, các ký hiệu tương tự như ở dạng bài trước.
Dạng 3: Bài tập tính số nguyên tử trong các phân tử phức tạp
Với dạng bài này, học sinh cần tính số nguyên tử của một nguyên tố trong phân tử phức tạp, ví dụ tính số nguyên tử oxy trong phân tử \(O_2\). Phương pháp giải sẽ là:
- Xác định số mol của phân tử phức tạp (ví dụ, số mol của \(O_2\)).
- Nhân số mol của phân tử với số nguyên tử của nguyên tố cần tìm trong phân tử đó (ví dụ, \(O_2\) có 2 nguyên tử oxy).
- Áp dụng công thức tính số nguyên tử tổng quát \(A = n \times N\).
Dạng 4: Bài tập tính số nguyên tử liên quan đến đồng vị
Bài tập này đòi hỏi học sinh tính toán dựa trên các đồng vị của nguyên tố và nguyên tử khối trung bình. Học sinh cần kết hợp kiến thức về số mol và thành phần phần trăm đồng vị để giải quyết vấn đề.
Với mỗi dạng bài tập, điều quan trọng là nắm rõ công thức và hiểu cách áp dụng chúng vào các tình huống cụ thể. Điều này sẽ giúp bạn giải quyết hiệu quả các bài toán liên quan đến số nguyên tử trong Hóa học lớp 10.

3. Mối liên hệ giữa số nguyên tử và các chủ đề Hóa học khác
Số nguyên tử không chỉ là khái niệm cơ bản trong Hóa học mà còn có mối liên hệ chặt chẽ với nhiều chủ đề quan trọng khác của môn học này. Việc hiểu rõ số nguyên tử giúp học sinh dễ dàng nắm bắt các khái niệm phức tạp hơn trong các chủ đề như cấu tạo nguyên tử, định luật tuần hoàn, và phản ứng hóa học. Các chủ đề này cũng được mở rộng và bổ sung thêm kiến thức trong các môn học khác như Vật lí và Sinh học.
- Cấu tạo nguyên tử và phân tử: Số nguyên tử liên quan mật thiết đến cách sắp xếp các electron trong lớp vỏ nguyên tử, quyết định tính chất hóa học của nguyên tố đó. Khái niệm này được sử dụng để giải thích bản chất của các hiện tượng hóa học và phản ứng hóa học.
- Định luật tuần hoàn: Số nguyên tử cũng xác định vị trí của một nguyên tố trong bảng tuần hoàn, từ đó giúp hiểu về các tính chất vật lý và hóa học của nguyên tố đó.
- Phản ứng hóa học: Số nguyên tử giúp giải thích cách các nguyên tử tham gia vào phản ứng, tạo ra các chất mới. Điều này còn liên quan đến khái niệm về số mol và tính toán lượng chất tham gia và tạo thành trong phản ứng.
- Mối liên hệ với Vật lí và Sinh học: Kiến thức về cấu tạo nguyên tử không chỉ quan trọng trong Hóa học mà còn liên quan đến các nguyên tắc cơ bản của Vật lí nguyên tử và Sinh học. Các khái niệm như cấu trúc hạt nhân, năng lượng liên kết và quá trình trao đổi chất đều có nền tảng từ kiến thức về số nguyên tử.
Hiểu được mối liên hệ này giúp học sinh có cái nhìn toàn diện hơn về Hóa học và các môn khoa học tự nhiên khác, giúp việc học trở nên dễ dàng và hiệu quả hơn.

4. Tổng hợp các công thức Hóa học lớp 10 liên quan
Chương trình Hóa học lớp 10 chứa đựng nhiều kiến thức nền tảng quan trọng liên quan đến cấu trúc nguyên tử, liên kết hóa học và các phản ứng hóa học. Dưới đây là một số công thức hóa học quan trọng học sinh cần nắm vững để giải quyết các bài toán liên quan.
- Công thức tính số mol: \[ n = \frac{m}{M} \] Trong đó, \(n\) là số mol, \(m\) là khối lượng chất (gam), \(M\) là khối lượng mol (gam/mol).
- Công thức tính nồng độ dung dịch: \[ C = \frac{n}{V} \] Trong đó, \(C\) là nồng độ mol/lít, \(n\) là số mol chất tan, \(V\) là thể tích dung dịch (lít).
- Phương trình phản ứng oxi hóa - khử: \[ \text{Tổng số electron nhường} = \text{Tổng số electron nhận} \] Công thức này thường được sử dụng trong các bài toán về phản ứng oxi hóa – khử.
- Công thức tính khối lượng muối: \[ m_{\text{muối}} = m_{\text{KL}} + m_{\text{gốc axit}} \] Công thức này áp dụng cho các bài toán khi cho kim loại phản ứng với axit.
- Công thức liên kết hóa học: Đối với hợp chất \(A_xB_y\), hiệu độ âm điện giúp xác định loại liên kết.
- Các công thức về bảng tuần hoàn:
- Số hiệu nguyên tử = Số proton = Số electron.
- Số lớp electron = Số chu kỳ.
- Số electron hóa trị = Số nhóm.
- Các công thức liên quan đến tốc độ phản ứng: \[ V = \frac{\Delta C}{\Delta t} \] Tốc độ phản ứng được tính bằng sự thay đổi nồng độ chất trong một khoảng thời gian nhất định.
Những công thức trên là nền tảng quan trọng để học sinh lớp 10 giải quyết các bài toán hóa học từ đơn giản đến phức tạp trong chương trình học. Hãy nắm vững để dễ dàng vượt qua các bài kiểm tra và kỳ thi.

5. Các bài tập có lời giải chi tiết
Các bài tập về tính số nguyên tử trong chương trình Hóa học lớp 10 thường yêu cầu học sinh tính toán dựa trên các công thức liên quan đến số mol, khối lượng mol, và số Avogadro. Dưới đây là một số bài tập cụ thể kèm theo hướng dẫn giải chi tiết để giúp các em học sinh nắm vững kiến thức và áp dụng hiệu quả trong các bài kiểm tra và thi cử.
- Bài tập 1: Xác định số nguyên tử của một nguyên tố trong một mẫu chất
- Bước 1: Sử dụng công thức \( N = n \times N_A \), trong đó \( N \) là số nguyên tử, \( n \) là số mol, và \( N_A \) là hằng số Avogadro \( 6,022 \times 10^{23} \).
- Bước 2: Thay số vào công thức \( N = 0,5 \times 6,022 \times 10^{23} = 3,011 \times 10^{23} \) nguyên tử.
- Bài tập 2: Tính số mol dựa trên số nguyên tử
- Bước 1: Sử dụng công thức \( n = \frac{N}{N_A} \), trong đó \( n \) là số mol, \( N \) là số nguyên tử, và \( N_A \) là hằng số Avogadro.
- Bước 2: Thay số vào công thức \( n = \frac{1,204 \times 10^{24}}{6,022 \times 10^{23}} = 2 \) mol.
- Bài tập 3: Bài toán liên quan đến khối lượng và số nguyên tử
- Bước 1: Tính số mol nhôm từ khối lượng: \( n = \frac{m}{M} \), trong đó \( m \) là khối lượng, \( M \) là khối lượng mol của Al (27 g/mol).
- Bước 2: \( n = \frac{10}{27} = 0,37 \) mol.
- Bước 3: Tính số nguyên tử bằng cách nhân số mol với hằng số Avogadro: \( N = 0,37 \times 6,022 \times 10^{23} = 2,23 \times 10^{23} \) nguyên tử.
Ví dụ: Tính số nguyên tử có trong 0,5 mol nguyên tử sắt (Fe).
Giải:
Ví dụ: Có bao nhiêu mol nguyên tử trong \( 1,204 \times 10^{24} \) nguyên tử carbon?
Giải:
Ví dụ: Tính số nguyên tử trong 10g nguyên tử nhôm (Al).
Giải:
XEM THÊM:
6. Lời kết và một số lưu ý khi làm bài tập về số nguyên tử
Việc nắm vững các công thức và phương pháp tính số nguyên tử là rất quan trọng trong quá trình học Hóa học, đặc biệt là ở lớp 10. Để thành thạo trong việc giải các bài tập liên quan, các bạn cần chú ý đến một số điểm sau:
- Hiểu rõ bản chất của số mol và số nguyên tử: Số mol và số nguyên tử là hai khái niệm cốt lõi trong Hóa học. Nắm vững định nghĩa và mối quan hệ giữa chúng sẽ giúp bạn giải quyết nhiều dạng bài tập phức tạp.
- Áp dụng đúng công thức: Khi tính số nguyên tử, các bạn cần nhớ rằng công thức cơ bản nhất là:
- \(N\): Số nguyên tử
- \(n\): Số mol
- \(N_A\): Hằng số Avogadro (\(6,022 \times 10^{23}\) nguyên tử/mol)
- Luyện tập thường xuyên: Luyện tập là chìa khóa để thành thạo. Hãy làm thật nhiều bài tập từ cơ bản đến nâng cao để hiểu sâu sắc các công thức và cách áp dụng chúng.
- Chú ý đến các chi tiết nhỏ: Đôi khi, chỉ một sai sót nhỏ trong việc đặt đơn vị hoặc nhầm lẫn trong tính toán cũng có thể dẫn đến kết quả sai. Luôn kiểm tra kỹ lưỡng các bước làm bài của mình.
- Kết hợp kiến thức lý thuyết và thực hành: Ngoài việc làm bài tập, hãy cố gắng liên hệ kiến thức với các hiện tượng thực tế để hiểu rõ hơn về tầm quan trọng của các nguyên tử và phân tử trong cuộc sống.
\[N = n \times N_A\]
Trong đó:
Cuối cùng, hãy nhớ rằng Hóa học là một môn học đòi hỏi sự kiên nhẫn và chăm chỉ. Việc hiểu rõ và nắm vững các công thức tính số nguyên tử sẽ giúp bạn không chỉ đạt điểm cao trong các kỳ thi mà còn mở ra cánh cửa đến với những kiến thức cao hơn trong tương lai.