Chủ đề cách tính số nguyên tử lớp 8: Học cách tính số nguyên tử lớp 8 không chỉ giúp bạn hiểu rõ hơn về cấu tạo vật chất mà còn là nền tảng quan trọng cho các bài học hóa học sau này. Bài viết này sẽ hướng dẫn chi tiết và dễ hiểu, giúp bạn nắm vững kiến thức một cách nhanh chóng.
Mục lục
Cách Tính Số Nguyên Tử Lớp 8
Trong môn Hóa học lớp 8, việc tính số nguyên tử trong một chất là một kỹ năng cơ bản. Để thực hiện phép tính này, chúng ta cần hiểu rõ về các khái niệm như khối lượng mol, số Avogadro và cách sử dụng chúng trong các bài tập.
1. Khái Niệm Cơ Bản
- Khối lượng mol (\(M\)): Khối lượng của một mol chất, được tính bằng gam trên mol (g/mol).
- Số Avogadro (\(N_A\)): Số nguyên tử hoặc phân tử trong một mol chất, giá trị là \(6.022 \times 10^{23}\).
2. Công Thức Tính Số Nguyên Tử
Để tính số nguyên tử (\(N\)) trong một lượng chất, sử dụng công thức sau:
Trong đó:
- \(N\) là số nguyên tử.
- \(m\) là khối lượng của chất (đơn vị: gam).
- \(M\) là khối lượng mol của chất (đơn vị: g/mol).
- \(N_A\) là số Avogadro.
3. Ví Dụ Cụ Thể
Giả sử chúng ta có \(12\) gam cacbon (C), khối lượng mol của cacbon là \(12\) g/mol. Số nguyên tử cacbon trong mẫu này được tính như sau:
Vậy trong \(12\) gam cacbon có \(6.022 \times 10^{23}\) nguyên tử cacbon.
4. Bài Tập Thực Hành
Hãy tính số nguyên tử trong các chất sau:
- 18 g nước (H₂O), với khối lượng mol của nước là 18 g/mol.
- 32 g oxi (O₂), với khối lượng mol của oxi là 32 g/mol.
5. Kết Luận
Việc nắm vững công thức và cách tính số nguyên tử sẽ giúp các em giải quyết các bài tập hóa học một cách dễ dàng và chính xác hơn.
.png)
Tổng Quan Về Nguyên Tử Và Cấu Tạo Nguyên Tử
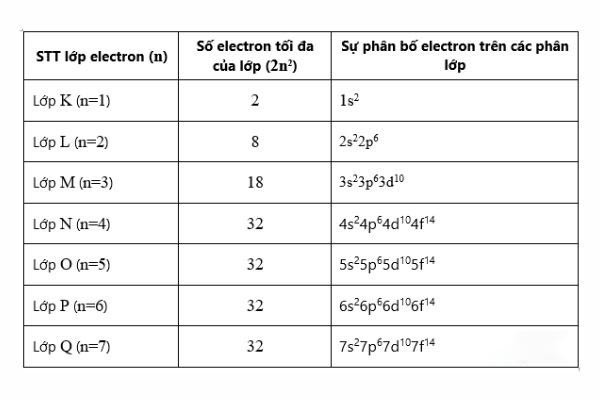
Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện, bao gồm một hạt nhân nằm ở trung tâm và các electron chuyển động xung quanh. Hạt nhân chứa các proton mang điện tích dương và neutron không mang điện. Số lượng proton trong hạt nhân xác định số nguyên tử và định nghĩa nên tính chất hóa học của nguyên tố. Để biểu diễn số electron của nguyên tử, ta phân bố chúng vào các lớp vỏ theo quy tắc 2n2, trong đó \(n\) là số thứ tự của lớp.
Số nguyên tử: Số nguyên tử của một nguyên tố bằng với số proton trong hạt nhân. Ví dụ, nguyên tử carbon có số proton bằng 6.
Cấu trúc nguyên tử:
- Hạt nhân: Gồm proton và neutron.
- Vỏ electron: Các electron được phân bố theo lớp vỏ K, L, M,... theo thứ tự năng lượng tăng dần.
Quy tắc phân bố electron:
- Phân bố electron vào lớp vỏ có năng lượng thấp nhất trước.
- Theo quy tắc Hund, các electron sẽ chiếm các orbital trống trước khi ghép đôi.
Ví dụ phân bố electron:
| Nguyên tố | Số proton | Số lớp vỏ electron | Phân bố electron |
| Hydro (H) | 1 | 1 | K: 1 |
| Carbon (C) | 6 | 2 | K: 2, L: 4 |
Phương Pháp Tính Số Nguyên Tử Trong Một Mẫu Chất
Để tính số nguyên tử trong một mẫu chất, ta cần hiểu và áp dụng đúng các bước sau đây:
- Xác định khối lượng mol của chất:
- Tính số mol của chất trong mẫu:
- \(n\): Số mol chất
- \(m\): Khối lượng của mẫu chất (g)
- \(M\): Khối lượng mol của chất (g/mol)
- Tính số nguyên tử:
- \(N_A\): Số Avogadro, \(N_A = 6.022 \times 10^{23}\) nguyên tử/mol
Khối lượng mol (g/mol) là khối lượng của một mol nguyên tử hoặc phân tử của chất đó. Ví dụ, khối lượng mol của carbon là 12 g/mol.
Ta sử dụng công thức:
\[
n = \frac{m}{M}
\]
Trong đó:
Ví dụ, nếu có 24g carbon, số mol của nó sẽ là:
\[
n = \frac{24 \, \text{g}}{12 \, \text{g/mol}} = 2 \, \text{mol}
\]
Số nguyên tử trong một mẫu chất được tính bằng công thức:
\[
\text{Số nguyên tử} = n \times N_A
\]
Trong đó:
Ví dụ, với 2 mol carbon, số nguyên tử carbon sẽ là:
\[
\text{Số nguyên tử} = 2 \, \text{mol} \times 6.022 \times 10^{23} \, \text{nguyên tử/mol} = 1.2044 \times 10^{24} \, \text{nguyên tử}
\]
Với phương pháp này, bạn có thể dễ dàng tính toán được số nguyên tử trong bất kỳ mẫu chất nào khi biết khối lượng của mẫu và khối lượng mol của chất đó.

Các Bài Tập Thực Hành Và Giải Chi Tiết
Dưới đây là một số bài tập thực hành về tính số nguyên tử trong các mẫu chất, cùng với lời giải chi tiết từng bước:
- Bài tập 1: Tính số nguyên tử carbon trong 36g carbon dioxide (CO₂).
- Bước 1: Tính khối lượng mol của CO₂:
\[
M_{\text{CO}_2} = 12 + 2 \times 16 = 44 \, \text{g/mol}
\] - Bước 2: Tính số mol CO₂ trong 36g:
\[
n = \frac{36 \, \text{g}}{44 \, \text{g/mol}} = 0.818 \, \text{mol}
\] - Bước 3: Tính số mol nguyên tử carbon trong CO₂:
\[
n_{\text{C}} = n \times 1 = 0.818 \, \text{mol}
\] - Bước 4: Tính số nguyên tử carbon:
\[
\text{Số nguyên tử C} = 0.818 \times 6.022 \times 10^{23} = 4.926 \times 10^{23} \, \text{nguyên tử}
\] - Bài tập 2: Tính số nguyên tử hydrogen trong 18g nước (H₂O).
- Bước 1: Tính khối lượng mol của H₂O:
\[
M_{\text{H}_2\text{O}} = 2 \times 1 + 16 = 18 \, \text{g/mol}
\] - Bước 2: Tính số mol H₂O trong 18g:
\[
n = \frac{18 \, \text{g}}{18 \, \text{g/mol}} = 1 \, \text{mol}
\] - Bước 3: Tính số mol nguyên tử hydrogen trong H₂O:
\[
n_{\text{H}} = n \times 2 = 2 \, \text{mol}
\] - Bước 4: Tính số nguyên tử hydrogen:
\[
\text{Số nguyên tử H} = 2 \times 6.022 \times 10^{23} = 1.2044 \times 10^{24} \, \text{nguyên tử}
\] - Bài tập 3: Tính số nguyên tử oxygen trong 32g O₂.
- Bước 1: Tính khối lượng mol của O₂:
\[
M_{\text{O}_2} = 2 \times 16 = 32 \, \text{g/mol}
\] - Bước 2: Tính số mol O₂ trong 32g:
\[
n = \frac{32 \, \text{g}}{32 \, \text{g/mol}} = 1 \, \text{mol}
\] - Bước 3: Tính số mol nguyên tử oxygen trong O₂:
\[
n_{\text{O}} = n \times 2 = 2 \, \text{mol}
\] - Bước 4: Tính số nguyên tử oxygen:
\[
\text{Số nguyên tử O} = 2 \times 6.022 \times 10^{23} = 1.2044 \times 10^{24} \, \text{nguyên tử}
\]
Giải:
Giải:
Giải:
Những bài tập trên giúp học sinh lớp 8 hiểu rõ hơn về cách tính số nguyên tử trong các mẫu chất, cũng như cách áp dụng kiến thức hóa học vào các bài toán thực tế.

Một Số Lưu Ý Quan Trọng Khi Tính Số Nguyên Tử
Khi thực hiện các phép tính số nguyên tử trong một mẫu chất, có một số điểm quan trọng mà bạn cần chú ý để đảm bảo kết quả chính xác:
- Xác định khối lượng mol chính xác: Khối lượng mol của các nguyên tố hoặc hợp chất cần được xác định đúng theo bảng tuần hoàn. Ví dụ, khối lượng mol của carbon (C) là 12 g/mol và của oxygen (O) là 16 g/mol.
- Chuyển đổi khối lượng sang số mol: Sử dụng công thức \[ n = \frac{m}{M} \] trong đó \( n \) là số mol, \( m \) là khối lượng chất (g), và \( M \) là khối lượng mol (g/mol).
- Tính số nguyên tử từ số mol: Sử dụng hằng số Avogadro (\( 6.022 \times 10^{23} \)) để chuyển đổi số mol thành số nguyên tử, theo công thức: \[ \text{Số nguyên tử} = n \times 6.022 \times 10^{23} \]
- Chú ý đơn vị tính: Luôn đảm bảo rằng tất cả các đơn vị trong quá trình tính toán phải phù hợp và chính xác để tránh sai sót trong kết quả cuối cùng.
- Xem xét các yếu tố ảnh hưởng: Trong một số trường hợp, cần xem xét đến yếu tố như nhiệt độ, áp suất hoặc trạng thái vật lý của chất để điều chỉnh tính toán cho phù hợp.
Việc nắm vững các lưu ý trên sẽ giúp bạn thực hiện các bài toán liên quan đến tính số nguyên tử một cách chính xác và hiệu quả hơn.

Ứng Dụng Của Việc Tính Số Nguyên Tử Trong Đời Sống
Việc tính toán số nguyên tử không chỉ quan trọng trong học tập mà còn có nhiều ứng dụng thực tiễn trong đời sống hàng ngày. Dưới đây là một số ví dụ nổi bật về ứng dụng của việc tính số nguyên tử:
- Phân tích thành phần hóa học: Trong các phòng thí nghiệm, việc tính số nguyên tử giúp xác định thành phần cụ thể của một chất, từ đó hỗ trợ trong việc phân tích và phát triển các sản phẩm hóa học.
- Sản xuất vật liệu: Các kỹ sư và nhà khoa học sử dụng tính toán số nguyên tử để thiết kế và phát triển các loại vật liệu mới, như hợp kim và chất dẻo, với các đặc tính mong muốn.
- Dược phẩm: Trong ngành dược phẩm, việc tính toán số nguyên tử đóng vai trò quan trọng trong việc xác định liều lượng chính xác của các thành phần hoạt chất trong thuốc, đảm bảo an toàn và hiệu quả cho người dùng.
- Nông nghiệp: Việc tính số nguyên tử giúp tối ưu hóa việc sử dụng phân bón và các chất dinh dưỡng trong nông nghiệp, nhằm tăng cường năng suất cây trồng mà không gây hại đến môi trường.
- Môi trường: Tính toán số nguyên tử là cơ sở để kiểm tra và kiểm soát lượng khí thải độc hại trong môi trường, giúp giảm thiểu tác động xấu đến khí quyển và hệ sinh thái.
Nhờ vào việc nắm vững cách tính số nguyên tử, chúng ta có thể ứng dụng kiến thức này vào nhiều lĩnh vực khác nhau, từ nghiên cứu khoa học đến phát triển các sản phẩm công nghiệp và bảo vệ môi trường.