Chủ đề chất nào có nhiệt tạo thành chuẩn bằng 0: Chất nào có nhiệt tạo thành chuẩn bằng 0 là câu hỏi thường gặp trong hóa học, đặc biệt là khi tính toán các phản ứng hóa học. Trong bài viết này, chúng ta sẽ tìm hiểu về các chất có nhiệt tạo thành chuẩn bằng 0, cũng như vai trò của chúng trong các phản ứng hóa học và ứng dụng thực tiễn.
Mục lục
Chất có Nhiệt Tạo Thành Chuẩn Bằng 0
Nhiệt tạo thành chuẩn (hay enthalpy tạo thành chuẩn) của một chất là lượng nhiệt kèm theo khi một mol chất đó được tạo thành từ các đơn chất ở dạng bền nhất của chúng trong điều kiện chuẩn. Điều này có nghĩa là, đối với các đơn chất bền nhất như O2 (khí), N2 (khí), hoặc C (dạng graphite), nhiệt tạo thành chuẩn bằng 0 vì không có sự biến đổi nào từ dạng bền nhất của chúng.
Một số ví dụ về các chất có nhiệt tạo thành chuẩn bằng 0:
- O2 (khí) - Oxy ở trạng thái phân tử khí
- N2 (khí) - Nitơ ở trạng thái phân tử khí
- C (graphite) - Carbon ở dạng graphite
- H2 (khí) - Hydro ở trạng thái phân tử khí
Tại sao nhiệt tạo thành chuẩn bằng 0?
Với các đơn chất ở trạng thái bền nhất, không có quá trình biến đổi nào xảy ra để tạo ra chúng từ một chất khác. Do đó, không có năng lượng cần thiết để thực hiện quá trình này, dẫn đến nhiệt tạo thành chuẩn bằng 0. Điều này thường được áp dụng trong các tính toán nhiệt động học để xác định sự thay đổi nhiệt lượng trong các phản ứng hóa học.
Ứng dụng của nhiệt tạo thành chuẩn trong hóa học
Trong hóa học, nhiệt tạo thành chuẩn được sử dụng rộng rãi để tính toán nhiệt lượng tỏa ra hoặc hấp thụ trong các phản ứng hóa học. Nó là cơ sở để xác định sự ổn định và phản ứng của các chất hóa học. Khi biết được nhiệt tạo thành chuẩn của các chất, ta có thể dự đoán được liệu một phản ứng có tỏa nhiệt hay hấp thụ nhiệt, và do đó có thể ứng dụng trong việc thiết kế các quy trình công nghiệp, như tổng hợp hóa chất, sản xuất năng lượng và các quy trình nhiệt động khác.
Kết luận
Hiểu về nhiệt tạo thành chuẩn và việc các chất như O2, N2, và C có nhiệt tạo thành chuẩn bằng 0 là nền tảng quan trọng trong việc nghiên cứu và ứng dụng hóa học, đặc biệt trong các tính toán liên quan đến nhiệt động học và thiết kế các quy trình công nghiệp.
.png)
1. Khái niệm về nhiệt tạo thành chuẩn
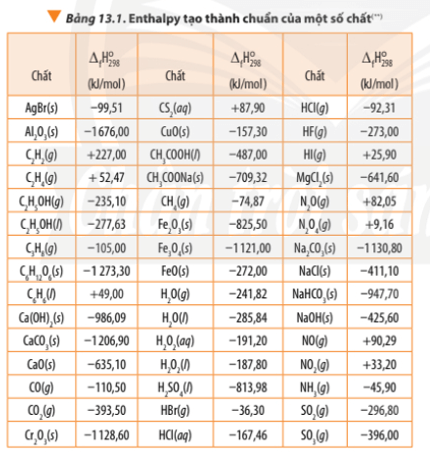
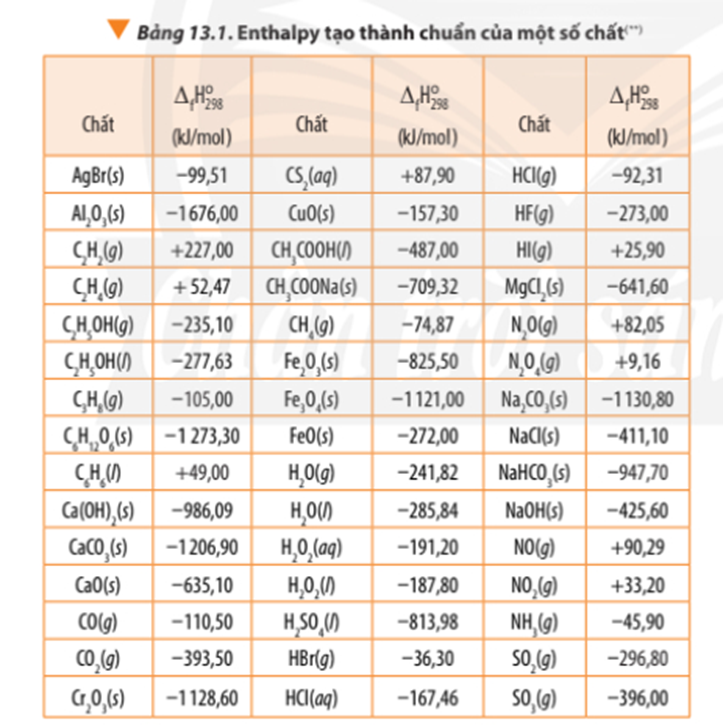
Nhiệt tạo thành chuẩn ($\Delta H_f^\circ$) là lượng nhiệt cần thiết để hình thành 1 mol chất từ các đơn chất cấu thành ở trạng thái chuẩn. Trạng thái chuẩn là điều kiện tiêu chuẩn với áp suất 1 atm và nhiệt độ $25^\circ C$ (298 K). Các đơn chất ở dạng bền vững nhất của chúng như $O_2(g)$, $H_2(g)$, hay $C(graphite)$ có nhiệt tạo thành chuẩn bằng 0.
- Nhiệt tạo thành chuẩn thường được sử dụng để tính toán biến thiên enthalpy của các phản ứng hóa học thông qua phương trình: \[ \Delta H_{reaction}^\circ = \sum \Delta H_f^\circ (sản phẩm) - \sum \Delta H_f^\circ (tác chất) \]
- Nhiệt tạo thành chuẩn giúp xác định mức độ ổn định của các hợp chất hóa học, hỗ trợ trong việc thiết kế và điều chỉnh các quá trình hóa học.
2. Những chất có nhiệt tạo thành chuẩn bằng 0
Các chất có nhiệt tạo thành chuẩn bằng 0 thường là các đơn chất ở dạng bền vững nhất của chúng ở điều kiện tiêu chuẩn (1 atm và 25°C). Những đơn chất này bao gồm:
- Khí oxy ($O_2$): Là dạng phân tử bền vững nhất của oxy, với nhiệt tạo thành chuẩn bằng 0.
- Khí nitơ ($N_2$): Ở dạng khí, nitơ cũng có nhiệt tạo thành chuẩn bằng 0 do đây là dạng ổn định nhất.
- Khí hydro ($H_2$): Đơn chất hydro ở trạng thái phân tử có nhiệt tạo thành chuẩn bằng 0.
- Cacbon dạng graphit: Dạng thù hình bền vững nhất của cacbon là graphit, có nhiệt tạo thành chuẩn bằng 0.
- Kim loại: Nhiều kim loại ở trạng thái đơn chất như sắt (Fe), nhôm (Al) đều có nhiệt tạo thành chuẩn bằng 0.
Các đơn chất trên là cơ sở để tính toán nhiệt tạo thành chuẩn của các hợp chất, giúp hiểu rõ hơn về mức độ ổn định và phản ứng của các chất trong hóa học.

3. Ứng dụng của nhiệt tạo thành chuẩn trong hóa học
Nhiệt tạo thành chuẩn (\(\Delta H_f^o\)) là một khái niệm quan trọng trong hóa học, được sử dụng rộng rãi trong nhiều lĩnh vực nghiên cứu và ứng dụng thực tế. Dưới đây là một số ứng dụng chính của nhiệt tạo thành chuẩn trong hóa học:
- Tính toán năng lượng phản ứng: Nhiệt tạo thành chuẩn được sử dụng để tính toán nhiệt phản ứng (\(\Delta H_r^o\)) của một phản ứng hóa học bằng cách áp dụng định luật Hess. Phương trình cơ bản là: \[ \Delta H_r^o = \sum \Delta H_f^o (\text{sản phẩm}) - \sum \Delta H_f^o (\text{chất phản ứng}) \] Điều này giúp xác định xem phản ứng là tỏa nhiệt hay thu nhiệt, từ đó dự đoán các điều kiện nhiệt độ cần thiết cho phản ứng.
- Dự đoán tính ổn định của hợp chất: Giá trị nhiệt tạo thành chuẩn cho thấy mức độ bền vững của các chất. Hợp chất có \(\Delta H_f^o\) âm thường ổn định hơn vì năng lượng cần thiết để phân hủy nó sẽ lớn hơn.
- Thiết kế quy trình công nghiệp: Trong công nghiệp hóa chất, nhiệt tạo thành chuẩn được sử dụng để tính toán nhiệt lượng cần thiết hoặc sinh ra trong quá trình sản xuất. Điều này quan trọng trong việc tối ưu hóa năng lượng và giảm thiểu chi phí.
- Nghiên cứu nhiệt động học: Nhiệt tạo thành chuẩn là một trong những dữ liệu cơ bản để phân tích nhiệt động học của các quá trình hóa học, từ đó có thể xác định các yếu tố như hằng số cân bằng, năng lượng Gibbs tự do, và khả năng xảy ra của các phản ứng.
XEM THÊM:
4. Câu hỏi thường gặp về nhiệt tạo thành chuẩn
Dưới đây là một số câu hỏi thường gặp liên quan đến nhiệt tạo thành chuẩn (\(\Delta H_f^o\)), một khái niệm quan trọng trong hóa học nhiệt động:
- Nhiệt tạo thành chuẩn là gì?
Nhiệt tạo thành chuẩn là năng lượng thay đổi khi một mol chất được hình thành từ các nguyên tố cấu thành của nó trong trạng thái chuẩn (thường là 1 atm áp suất và 298.15 K nhiệt độ).
- Tại sao một số chất có nhiệt tạo thành chuẩn bằng 0?
Các nguyên tố trong trạng thái cơ bản, như \(O_2\) (oxy phân tử) hay \(C\) (than chì), có nhiệt tạo thành chuẩn bằng 0 vì chúng là dạng bền nhất của các nguyên tố này ở điều kiện chuẩn.
- Làm thế nào để tính nhiệt phản ứng từ nhiệt tạo thành chuẩn?
Có thể tính nhiệt phản ứng (\(\Delta H_r^o\)) bằng cách sử dụng phương trình:
\[
\Delta H_r^o = \sum \Delta H_f^o (\text{sản phẩm}) - \sum \Delta H_f^o (\text{chất phản ứng})
\]
Điều này giúp xác định liệu phản ứng là tỏa nhiệt hay thu nhiệt. - Ứng dụng của nhiệt tạo thành chuẩn là gì?
Nhiệt tạo thành chuẩn được sử dụng rộng rãi trong tính toán năng lượng của các phản ứng hóa học, đánh giá tính ổn định của hợp chất, và tối ưu hóa quy trình công nghiệp.