Chủ đề delta h 0 là phản ứng thu nhiệt: Delta H 0 là phản ứng thu nhiệt đóng vai trò quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về sự biến đổi năng lượng trong các phản ứng. Bài viết này sẽ khám phá chi tiết về khái niệm, tính toán, và những ứng dụng thực tế của phản ứng thu nhiệt trong đời sống và công nghiệp.
Mục lục
Phản ứng thu nhiệt và delta H
Phản ứng thu nhiệt là một loại phản ứng hóa học trong đó hệ thống hấp thụ nhiệt từ môi trường xung quanh. Điều này có nghĩa là năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng lớn hơn năng lượng giải phóng khi các sản phẩm được hình thành. Kết quả là môi trường xung quanh trở nên lạnh hơn.
Đặc điểm của phản ứng thu nhiệt
- Nhiệt độ của môi trường xung quanh giảm khi phản ứng xảy ra.
- , có nghĩa là hệ thống hấp thụ năng lượng từ môi trường.
- Phản ứng thường cần cung cấp năng lượng từ bên ngoài để tiếp tục xảy ra.
Công thức tính delta H
Công thức tổng quát để tính cho một phản ứng hóa học là:
Ví dụ về phản ứng thu nhiệt
- Phản ứng phân hủy: , với . Nhiệt được hấp thụ để phân hủy canxi cacbonat thành canxi oxit và khí cacbon đioxit.
- Phản ứng hòa tan: , với . Khi ammonium nitrate hòa tan trong nước, nhiệt được hấp thụ, làm nước lạnh đi.
Ứng dụng của phản ứng thu nhiệt
- Sử dụng trong các hệ thống làm lạnh và điều hòa không khí.
- Áp dụng trong các gói lạnh y tế để giảm sưng và đau.
- Được sử dụng trong quá trình sản xuất công nghiệp cần kiểm soát nhiệt độ.
.png)
1. Khái niệm và định nghĩa về phản ứng thu nhiệt
Phản ứng thu nhiệt là một loại phản ứng hóa học trong đó hệ thống hấp thụ nhiệt từ môi trường xung quanh. Đây là một quá trình mà nhiệt lượng được lấy vào từ môi trường để thực hiện phản ứng, khiến môi trường xung quanh trở nên lạnh hơn. Phản ứng này thường đi kèm với sự tăng entropy và cần cung cấp năng lượng liên tục để duy trì.
Về mặt nhiệt động học, phản ứng thu nhiệt được định nghĩa là phản ứng có biến thiên enthalpy (Delta H) dương, tức là . Điều này có nghĩa là năng lượng cần thiết để phá vỡ các liên kết hóa học trong chất phản ứng lớn hơn năng lượng được giải phóng khi tạo thành sản phẩm mới. Do đó, nhiệt lượng từ môi trường được hấp thụ vào hệ thống để cân bằng năng lượng.
- Phản ứng thu nhiệt là phản ứng có , cho thấy hệ thống cần hấp thụ năng lượng từ môi trường.
- Nhiệt độ của môi trường xung quanh giảm khi phản ứng thu nhiệt diễn ra.
- Quá trình này thường cần có nguồn năng lượng bên ngoài cung cấp liên tục để duy trì phản ứng.
Một ví dụ điển hình của phản ứng thu nhiệt là phản ứng phân hủy để tạo ra và , trong đó nhiệt độ cần thiết để phản ứng xảy ra là rất cao và nhiệt lượng phải được cung cấp liên tục từ môi trường bên ngoài.
2. Delta H và các khái niệm liên quan
Delta H (ΔH) là một khái niệm quan trọng trong hóa học, được sử dụng để mô tả sự thay đổi về enthalpy, hay nhiệt lượng, trong một phản ứng hóa học. Đó là sự chênh lệch giữa enthalpy của các sản phẩm và enthalpy của các chất ban đầu.
2.1 Delta H là gì?
Delta H, hay biến thiên enthalpy, được định nghĩa là lượng nhiệt mà hệ thống hấp thụ hoặc giải phóng trong quá trình phản ứng. Công thức cơ bản để tính Delta H là:
\[\Delta H = H_{sản phẩm} - H_{chất ban đầu}\]
Nếu ΔH > 0, phản ứng được gọi là phản ứng thu nhiệt (endothermic), nghĩa là hệ thống hấp thụ nhiệt từ môi trường xung quanh. Ngược lại, nếu ΔH < 0, phản ứng là phản ứng tỏa nhiệt (exothermic), nghĩa là nhiệt được giải phóng ra ngoài.
2.2 Cách tính toán Delta H trong phản ứng hóa học
Để tính toán ΔH của một phản ứng hóa học, ta sử dụng enthalpy của các sản phẩm và chất ban đầu. Một phương pháp phổ biến là sử dụng nhiệt hình thành chuẩn (standard enthalpy of formation) của các chất, được xác định trong điều kiện chuẩn (298K và 1 atm). Công thức tổng quát là:
\[\Delta H = \sum \Delta H_{sản phẩm} - \sum \Delta H_{chất ban đầu}\]
Ví dụ, trong phản ứng phân hủy CaCO3:
\[\text{CaCO}_3(s) \rightarrow \text{CaO}(s) + \text{CO}_2(g)\]
\[\Delta H = +178 \text{ kJ/mol}\]
Trong phản ứng này, năng lượng được hấp thụ để phá vỡ liên kết trong CaCO3, làm cho ΔH dương, đặc trưng cho một phản ứng thu nhiệt.
2.3 Các loại Delta H trong hóa học
Có nhiều loại ΔH khác nhau trong hóa học, mỗi loại đặc trưng cho một kiểu phản ứng hoặc quá trình cụ thể:
- ΔHphản ứng: Biến thiên enthalpy của một phản ứng hóa học tổng quát.
- ΔHhình thành: Biến thiên enthalpy khi một mol hợp chất được tạo thành từ các đơn chất bền vững trong điều kiện chuẩn.
- ΔHphân hủy: Biến thiên enthalpy khi một chất bị phân hủy thành các chất đơn giản hơn.
- ΔHhòa tan: Biến thiên enthalpy khi một chất hòa tan trong dung môi để tạo thành dung dịch.

3. Ví dụ về các phản ứng thu nhiệt
3.1 Phản ứng phân hủy thu nhiệt
Một ví dụ điển hình của phản ứng thu nhiệt là phản ứng phân hủy canxi cacbonat (CaCO3) khi nung nóng. Trong quá trình này, canxi cacbonat bị phân hủy thành canxi oxit (CaO) và khí carbon dioxide (CO2). Phản ứng này đòi hỏi nhiệt lượng từ bên ngoài để xảy ra, tức là hệ thống phải hấp thụ năng lượng:
\[
\text{CaCO}_{3(s)} \rightarrow \text{CaO}_{(s)} + \text{CO}_{2(g)}
\]
3.2 Phản ứng hòa tan thu nhiệt
Một ví dụ khác của phản ứng thu nhiệt là quá trình hòa tan ammonium nitrate (NH4NO3) trong nước. Khi muối này hòa tan, nó hấp thụ nhiệt từ môi trường xung quanh, làm giảm nhiệt độ của dung dịch. Đây là lý do tại sao nó thường được sử dụng trong các gói làm lạnh tức thời:
\[
\text{NH}_{4}\text{NO}_{3(s)} \rightarrow \text{NH}_{4}^{+}(aq) + \text{NO}_{3}^{-}(aq)
\]
3.3 Phản ứng giữa barium hydroxide và ammonium chloride
Phản ứng giữa barium hydroxide (Ba(OH)2) và ammonium chloride (NH4Cl) cũng là một ví dụ minh họa cho phản ứng thu nhiệt. Phản ứng này tạo ra một hiệu ứng làm lạnh mạnh mẽ do nhiệt độ của hệ thống giảm đáng kể:
\[
\text{Ba(OH)}_{2(s)} + 2\text{NH}_{4}\text{Cl}_{(s)} \rightarrow \text{BaCl}_{2(aq)} + 2\text{NH}_{3(g)} + 2\text{H}_{2}\text{O}_{(l)}
\]
3.4 Quá trình quang hợp
Quá trình quang hợp ở thực vật là một phản ứng thu nhiệt tự nhiên, trong đó cây xanh hấp thụ năng lượng ánh sáng để chuyển đổi khí carbon dioxide (CO2) và nước (H2O) thành glucose (C6H12O6) và oxy (O2).
\[
6\text{CO}_{2} + 6\text{H}_{2}\text{O} + \text{ánh sáng} \rightarrow \text{C}_{6}\text{H}_{12}\text{O}_{6} + 6\text{O}_{2}
\]
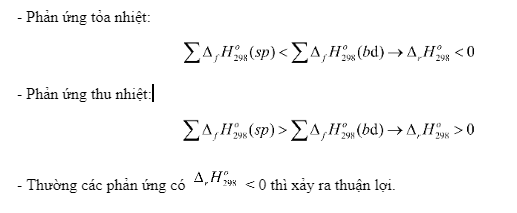
4. Ứng dụng của phản ứng thu nhiệt trong đời sống
Phản ứng thu nhiệt có nhiều ứng dụng quan trọng trong đời sống hàng ngày và các ngành công nghiệp. Dưới đây là một số ví dụ tiêu biểu:
4.1 Ứng dụng trong hệ thống làm lạnh và điều hòa không khí
Hệ thống làm lạnh và điều hòa không khí là một trong những ứng dụng phổ biến nhất của phản ứng thu nhiệt. Trong các thiết bị này, chất làm lạnh (thường là một loại khí) sẽ hấp thụ nhiệt từ không gian cần làm mát và sau đó giải phóng nhiệt ra môi trường bên ngoài. Quá trình này giúp duy trì nhiệt độ ổn định và mát mẻ trong các tòa nhà và phương tiện giao thông.
4.2 Sử dụng trong y tế để giảm sưng và đau
Phản ứng thu nhiệt cũng được áp dụng trong y tế, đặc biệt là trong các thiết bị và sản phẩm giảm sưng, giảm đau. Các túi lạnh, thường chứa một chất lỏng hoặc gel, khi được kích hoạt sẽ hấp thụ nhiệt từ cơ thể, giúp giảm nhiệt độ cục bộ và giảm sưng, đau trong các chấn thương cơ, khớp.
4.3 Ứng dụng trong sản xuất công nghiệp
Trong công nghiệp, phản ứng thu nhiệt được ứng dụng trong các quy trình hóa học như sản xuất phân bón, chất hóa học, và vật liệu xây dựng. Một ví dụ điển hình là phản ứng phân hủy canxi cacbonat (CaCO3) để sản xuất vôi sống (CaO), một nguyên liệu quan trọng trong ngành xây dựng.
Những ứng dụng này minh họa sự quan trọng của phản ứng thu nhiệt không chỉ trong đời sống hàng ngày mà còn trong các quy trình sản xuất công nghiệp, góp phần cải thiện hiệu suất và chất lượng sản phẩm.

5. Ý nghĩa của dấu và giá trị Delta H trong phản ứng hóa học
Trong hóa học, Delta H (ΔH) là một đại lượng quan trọng biểu thị sự thay đổi enthalpy (nhiệt ẩn) của hệ thống trong quá trình phản ứng. Dấu và giá trị của ΔH mang ý nghĩa đặc biệt trong việc xác định tính chất của phản ứng, cụ thể là phản ứng thu nhiệt hay tỏa nhiệt.
5.1 Delta H dương và phản ứng thu nhiệt
Khi ΔH có giá trị dương (ΔH > 0), điều này có nghĩa là phản ứng thu nhiệt, hệ thống hấp thụ nhiệt từ môi trường xung quanh để xảy ra. Các phản ứng này thường làm cho môi trường xung quanh lạnh đi do nhiệt lượng bị hấp thụ vào hệ thống.
Ví dụ: Quá trình hòa tan muối amoni clorua (NH4Cl) trong nước là một phản ứng thu nhiệt. Trong quá trình này, năng lượng được hấp thụ từ môi trường để phá vỡ các liên kết trong muối, dẫn đến nhiệt độ dung dịch giảm.
5.2 Sự khác biệt giữa phản ứng thu nhiệt và phản ứng tỏa nhiệt
Phản ứng thu nhiệt (ΔH > 0) khác với phản ứng tỏa nhiệt (ΔH < 0) ở chỗ, trong phản ứng thu nhiệt, nhiệt lượng được hấp thụ vào hệ thống, trong khi phản ứng tỏa nhiệt thì nhiệt lượng được giải phóng ra môi trường. Điều này làm cho phản ứng thu nhiệt cần năng lượng để tiếp diễn, còn phản ứng tỏa nhiệt thường tự xảy ra và có thể sinh ra năng lượng.
Để tính toán chính xác ΔH của một phản ứng, người ta thường sử dụng dữ liệu nhiệt động học hoặc các phương pháp như phương trình Hess. Việc hiểu rõ và áp dụng đúng ΔH giúp dự đoán và điều chỉnh quá trình phản ứng theo mong muốn.
Ứng dụng: Việc xác định ΔH giúp đánh giá tính khả thi của phản ứng trong các ứng dụng công nghiệp, y tế và đời sống. Chẳng hạn, các phản ứng thu nhiệt được sử dụng trong quá trình làm lạnh hoặc trong các thiết bị y tế như túi chườm lạnh.