Chủ đề quy ước về dấu của nhiệt lượng và công: Quy ước về dấu của nhiệt lượng và công là nền tảng quan trọng trong nhiệt động lực học, giúp phân tích và giải quyết các bài toán năng lượng. Bài viết này sẽ cung cấp cho bạn cái nhìn chi tiết và dễ hiểu về quy ước dấu, cùng với những ứng dụng thực tế trong các quá trình nhiệt động học.
Mục lục
- Quy Ước Về Dấu Của Nhiệt Lượng Và Công
- 1. Quy Ước Về Dấu Của Nhiệt Lượng (Q)
- 2. Quy Ước Về Dấu Của Công (A)
- 3. Các Quá Trình Nhiệt Động Lực Học Và Ứng Dụng Quy Ước Dấu
- 4. Bài Tập Áp Dụng Quy Ước Dấu Trong Các Quá Trình Nhiệt Động Lực Học
- 5. Các Lưu Ý Khi Áp Dụng Quy Ước Dấu
- 6. Tài Liệu Tham Khảo Về Quy Ước Dấu Của Nhiệt Lượng Và Công
Quy Ước Về Dấu Của Nhiệt Lượng Và Công
Trong nhiệt động lực học, dấu của nhiệt lượng (Q) và công (A) được quy ước như sau để thuận tiện cho việc phân tích và giải các bài toán liên quan:
1. Quy Ước Dấu Của Nhiệt Lượng (Q)
- Nếu hệ nhận nhiệt từ môi trường, nhiệt lượng Q được coi là dương (+).
- Nếu hệ truyền nhiệt ra môi trường, nhiệt lượng Q được coi là âm (-).
Quy ước này giúp dễ dàng xác định hướng truyền nhiệt và tình trạng năng lượng của hệ trong các quá trình nhiệt động lực học.
2. Quy Ước Dấu Của Công (A)
- Nếu hệ thực hiện công lên môi trường (ví dụ: hệ giãn nở và đẩy môi trường xung quanh), công A được coi là âm (-).
- Nếu môi trường thực hiện công lên hệ (ví dụ: môi trường nén hệ lại), công A được coi là dương (+).
Quy ước này có vai trò quan trọng trong việc phân tích sự biến đổi năng lượng trong các hệ kín hoặc hệ mở, đặc biệt là trong các quá trình như giãn nở đẳng nhiệt, đẳng áp, hoặc đẳng tích.
3. Ứng Dụng Của Quy Ước Dấu Trong Các Quá Trình Nhiệt Động Lực Học
Trong các quá trình nhiệt động lực học như đẳng nhiệt, đẳng áp, và đẳng tích, các quy ước về dấu của nhiệt lượng và công được áp dụng để xác định mối quan hệ giữa độ biến thiên nội năng (ΔU), nhiệt lượng (Q) và công (A) theo phương trình:
ΔU = Q + A
Ví dụ:
- Trong quá trình đẳng tích (A = 0), ΔU = Q. Độ biến thiên nội năng bằng nhiệt lượng mà hệ nhận được.
- Trong quá trình đẳng nhiệt (Q = 0), ΔU = A. Độ biến thiên nội năng bằng công mà hệ nhận được.
- Trong quá trình đẳng áp, ΔU = Q + A. Độ biến thiên nội năng bằng tổng công và nhiệt lượng mà hệ nhận được.
4. Kết Luận
Quy ước về dấu của nhiệt lượng và công là cơ sở quan trọng trong việc giải thích và phân tích các hiện tượng nhiệt động lực học. Việc hiểu rõ và áp dụng đúng quy ước này giúp ta dễ dàng hơn trong việc giải các bài toán liên quan đến năng lượng và sự biến đổi nhiệt trong các hệ nhiệt động lực học.

.png)
1. Quy Ước Về Dấu Của Nhiệt Lượng (Q)
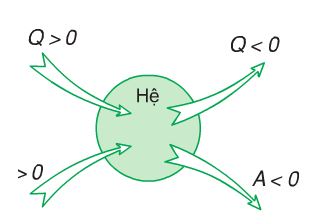
Trong nhiệt động lực học, nhiệt lượng \( Q \) được quy ước theo dấu nhằm xác định hướng của dòng nhiệt. Khi một hệ thống nhận nhiệt, \( Q \) sẽ dương (\( Q > 0 \)). Ngược lại, khi hệ thống truyền nhiệt ra môi trường bên ngoài, \( Q \) sẽ âm (\( Q < 0 \)). Quy ước này giúp chúng ta dễ dàng phân tích và tính toán trong các bài toán liên quan đến định luật nhiệt động lực học.
Một cách cụ thể, khi hệ thống hấp thụ năng lượng dưới dạng nhiệt lượng, năng lượng của hệ thống sẽ tăng lên, dẫn đến \( Q \) có giá trị dương. Khi hệ thống mất nhiệt, năng lượng giảm và \( Q \) trở nên âm.
2. Quy Ước Về Dấu Của Công (A)
Trong nhiệt động lực học, công (\( A \)) được quy ước theo dấu để xác định chiều tác dụng của lực và hướng chuyển động. Khi hệ thống thực hiện công lên môi trường xung quanh, \( A \) có giá trị dương (\( A > 0 \)). Ngược lại, khi công được thực hiện lên hệ thống, \( A \) có giá trị âm (\( A < 0 \)).
Ví dụ, nếu một khí trong piston nở ra và đẩy piston lên, khí thực hiện công và \( A \) sẽ dương. Ngược lại, nếu piston bị nén lại bởi lực bên ngoài, công được thực hiện lên hệ thống, và \( A \) trở nên âm.
Quy ước này giúp xác định rõ ràng các quá trình xảy ra trong hệ thống và là cơ sở để áp dụng các định luật cơ bản trong nhiệt động lực học, như định luật thứ nhất và thứ hai.

3. Các Quá Trình Nhiệt Động Lực Học Và Ứng Dụng Quy Ước Dấu
Trong các quá trình nhiệt động lực học, việc áp dụng quy ước dấu cho nhiệt lượng (\( Q \)) và công (\( A \)) là rất quan trọng để hiểu và phân tích các hiện tượng xảy ra trong hệ thống. Các quá trình này bao gồm:
- Quá trình đẳng tích: Trong quá trình này, thể tích của hệ thống không thay đổi. Công (\( A \)) bằng 0 và nhiệt lượng (\( Q \)) cung cấp cho hệ thống chỉ làm tăng nội năng.
- Quá trình đẳng áp: Áp suất của hệ thống không đổi. Nhiệt lượng (\( Q \)) được cung cấp cho hệ thống không chỉ làm tăng nội năng mà còn thực hiện công (\( A \)) lên môi trường.
- Quá trình đẳng nhiệt: Nhiệt độ của hệ thống không thay đổi. Công (\( A \)) thực hiện lên môi trường bằng nhiệt lượng (\( Q \)) được truyền vào hoặc ra khỏi hệ thống.
- Quá trình đoạn nhiệt: Không có nhiệt lượng (\( Q \)) trao đổi với môi trường, toàn bộ năng lượng thay đổi trong hệ thống là do công (\( A \)) thực hiện.
Trong mỗi quá trình, quy ước dấu giúp xác định chiều và giá trị của các đại lượng nhiệt động lực học, đảm bảo tính chính xác và nhất quán khi áp dụng các định luật cơ bản như định luật bảo toàn năng lượng.

4. Bài Tập Áp Dụng Quy Ước Dấu Trong Các Quá Trình Nhiệt Động Lực Học
Để củng cố kiến thức về quy ước dấu trong các quá trình nhiệt động lực học, dưới đây là một số bài tập mẫu áp dụng:
- Bài tập 1: Xác định công và nhiệt lượng trong quá trình đẳng tích khi hệ thống hấp thụ 500J nhiệt lượng. Áp dụng quy ước dấu để tính toán và giải thích kết quả.
- Bài tập 2: Cho một quá trình đẳng áp với nhiệt lượng \( Q = 1000J \) truyền vào hệ thống, tính công thực hiện bởi hệ thống. Sử dụng quy ước dấu để giải thích dấu của công.
- Bài tập 3: Trong quá trình đẳng nhiệt, hệ thống thực hiện công \( A = -200J \) lên môi trường. Tính nhiệt lượng \( Q \) trao đổi với hệ thống và giải thích kết quả theo quy ước dấu.
- Bài tập 4: Hệ thống trải qua một quá trình đoạn nhiệt với công \( A = 300J \) thực hiện lên hệ thống. Xác định nhiệt lượng \( Q \) trao đổi và giải thích tại sao nhiệt lượng lại bằng không trong quá trình này.
Các bài tập này giúp sinh viên hiểu rõ hơn về cách áp dụng quy ước dấu trong thực tế, từ đó nắm vững nguyên tắc và lý thuyết nhiệt động lực học.

5. Các Lưu Ý Khi Áp Dụng Quy Ước Dấu
Khi áp dụng quy ước dấu cho nhiệt lượng (Q) và công (A), có một số lưu ý quan trọng cần phải nắm vững để tránh nhầm lẫn trong quá trình giải bài tập cũng như trong các ứng dụng thực tế.
a. Lưu ý về sự tương tác giữa hệ và môi trường
Trong nhiệt động lực học, quy ước dấu phụ thuộc vào cách hệ trao đổi năng lượng với môi trường. Cụ thể:
- Nhiệt lượng (Q): Nhiệt lượng được coi là dương khi hệ nhận năng lượng từ môi trường, tức là năng lượng truyền vào hệ. Ngược lại, nếu hệ mất năng lượng ra môi trường, nhiệt lượng sẽ được coi là âm.
- Công (A): Công được quy ước là dương khi môi trường thực hiện công lên hệ (hệ hấp thụ năng lượng), và âm khi hệ thực hiện công lên môi trường (hệ mất năng lượng).
b. Lưu ý về các ngoại lệ trong các quá trình cụ thể
Một số quá trình nhiệt động lực học có thể đòi hỏi các quy ước dấu khác nhau, tùy thuộc vào điều kiện cụ thể của bài toán:
- Quá trình đẳng tích: Trong quá trình này, thể tích của hệ không thay đổi, vì vậy công thường bằng không. Điều này có nghĩa là toàn bộ sự thay đổi nội năng của hệ được quy cho nhiệt lượng.
- Quá trình đẳng áp: Với quá trình đẳng áp, công được tính dựa trên sự thay đổi thể tích của hệ dưới áp suất không đổi. Công trong quá trình này có thể là dương hoặc âm tùy thuộc vào sự giãn nở hay co lại của hệ.
- Quá trình đẳng nhiệt: Trong quá trình đẳng nhiệt, nhiệt độ của hệ không thay đổi. Do đó, sự thay đổi nội năng của hệ bằng không, và công thực hiện bởi hệ sẽ bằng nhiệt lượng trao đổi với môi trường.
Khi giải các bài tập liên quan đến quy ước dấu, điều quan trọng là phải xác định rõ hệ thống đang xét, hướng trao đổi năng lượng, và đặc tính của quá trình để áp dụng quy ước một cách chính xác. Hãy luôn đảm bảo hiểu rõ quy trình để tránh những sai sót không đáng có.
XEM THÊM:
6. Tài Liệu Tham Khảo Về Quy Ước Dấu Của Nhiệt Lượng Và Công
Để hiểu rõ hơn về quy ước dấu của nhiệt lượng và công, bạn có thể tham khảo một số tài liệu và nguồn thông tin đáng tin cậy sau đây:
- Giáo trình Nhiệt động lực học: Đây là một trong những nguồn tài liệu quan trọng và được sử dụng phổ biến trong giảng dạy tại các trường đại học. Giáo trình này cung cấp cái nhìn tổng quan về các khái niệm cơ bản của nhiệt động lực học, bao gồm cả quy ước dấu của nhiệt lượng và công.
- Sách Vật lý Đại cương: Cuốn sách này dành cho sinh viên ngành Khoa học và Kỹ thuật, giải thích chi tiết về các quy tắc và quy ước trong nhiệt động lực học. Phần liên quan đến quy ước dấu của nhiệt lượng và công được trình bày rõ ràng và có nhiều ví dụ minh họa.
- Bài giảng trực tuyến từ các trường đại học: Nhiều trường đại học tại Việt Nam và trên thế giới cung cấp các bài giảng trực tuyến về nhiệt động lực học. Các bài giảng này thường đi kèm với các tài liệu tham khảo và bài tập thực hành, giúp sinh viên nắm vững quy ước dấu của nhiệt lượng và công.
- Tài liệu trên các diễn đàn học thuật: Các diễn đàn học thuật như Stack Exchange, Diễn đàn Vật lý Việt Nam, và các nhóm học tập trực tuyến là nơi bạn có thể tìm kiếm sự trợ giúp từ cộng đồng, cũng như chia sẻ tài liệu và kiến thức về quy ước dấu của nhiệt lượng và công.
- Bài viết khoa học trên tạp chí chuyên ngành: Các tạp chí khoa học chuyên ngành Vật lý, Năng lượng, và Kỹ thuật thường có những bài viết phân tích chi tiết về các quy tắc trong nhiệt động lực học, bao gồm cả quy ước dấu của nhiệt lượng và công. Đây là nguồn tài liệu hữu ích cho những ai muốn tìm hiểu sâu hơn về chủ đề này.
Những tài liệu và nguồn thông tin trên sẽ giúp bạn hiểu rõ hơn về quy ước dấu của nhiệt lượng và công trong quá trình học tập và nghiên cứu.