Chủ đề phản ứng nhiệt nhôm hoàn toàn 3 48 gam oxit: Phản ứng nhiệt nhôm hoàn toàn 3,48 gam oxit là một bài toán hóa học thú vị và phổ biến trong chương trình học. Bài viết này cung cấp hướng dẫn chi tiết, từ lý thuyết đến cách giải bài toán cụ thể, giúp bạn nắm vững kiến thức và áp dụng vào thực tế.
Mục lục
Phản ứng nhiệt nhôm hoàn toàn với 3,48 gam oxit
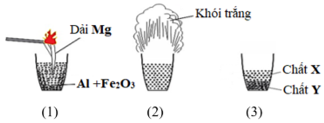
Phản ứng nhiệt nhôm là một phản ứng hóa học nổi tiếng trong đó nhôm (Al) phản ứng với oxit kim loại để tạo ra kim loại tự do và oxit nhôm (Al2O3). Đây là một phản ứng oxi hóa khử mạnh, thường được sử dụng để sản xuất các kim loại từ các oxit của chúng mà không cần sử dụng carbon như một chất khử.
Phương trình tổng quát của phản ứng nhiệt nhôm:
Phương trình tổng quát của phản ứng nhiệt nhôm có thể được viết như sau:
\[
\text{MxOy} + \text{Al} \rightarrow \text{M} + \text{Al}_2\text{O}_3
\]
Trong đó, \(\text{MxOy}\) là oxit kim loại và \(\text{M}\) là kim loại được tạo ra sau phản ứng.
Bài toán minh họa
Xét bài toán: Thực hiện phản ứng nhiệt nhôm hoàn toàn với 3,48 gam oxit FexOy, thu được 2,52 gam kim loại sắt (Fe). Khối lượng nhôm đã tham gia phản ứng là bao nhiêu?
Giả sử phản ứng xảy ra hoàn toàn, ta có thể giải quyết bài toán này thông qua các bước sau:
- Xác định số mol của sắt thu được: \[ n_{Fe} = \frac{2,52 \, \text{g}}{56 \, \text{g/mol}} = 0,045 \, \text{mol} \]
- Phương trình phản ứng cụ thể: \[ \text{FexOy} + 2y\text{Al} \rightarrow x\text{Fe} + \text{Al}_2\text{O}_3 \]
- Theo phương trình hóa học, số mol nhôm cần thiết để phản ứng với FexOy: \[ n_{Al} = \frac{y}{x} \times n_{Fe} \]
- Khối lượng nhôm đã phản ứng: \[ m_{Al} = n_{Al} \times 27 \, \text{g/mol} \]
Ứng dụng của phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm được sử dụng trong nhiều lĩnh vực công nghiệp, chẳng hạn như:
- Hàn đường sắt: Phản ứng nhiệt nhôm giúp hàn các thanh ray một cách chắc chắn và nhanh chóng.
- Sản xuất các kim loại như mangan, crôm, vanadi từ các oxit của chúng.
Phản ứng nhiệt nhôm là một ví dụ minh họa điển hình cho phản ứng oxi hóa khử, đặc biệt là trong lĩnh vực hóa học vô cơ và luyện kim.

.png)
Tổng quan về phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là một quá trình hóa học mạnh mẽ, trong đó nhôm (\(Al\)) tác dụng với các oxit kim loại để tạo ra kim loại tự do và oxit nhôm (\(Al_2O_3\)). Đây là một phản ứng oxi hóa khử điển hình, trong đó nhôm đóng vai trò là chất khử, còn oxit kim loại là chất oxi hóa. Phản ứng này thường được ứng dụng trong các quá trình luyện kim để chiết xuất kim loại từ quặng của chúng.
Phương trình tổng quát của phản ứng nhiệt nhôm có dạng:
\[
MxOy + yAl \rightarrow xM + \frac{y}{2} Al_2O_3
\]
Trong đó:
- \(MxOy\) là oxit kim loại (ví dụ: \(Fe_2O_3\), \(CuO\)).
- \(M\) là kim loại được tạo ra (ví dụ: \(Fe\), \(Cu\)).
- \(Al\) là nhôm tham gia phản ứng.
- \(Al_2O_3\) là oxit nhôm được tạo thành sau phản ứng.
Phản ứng nhiệt nhôm thường được tiến hành ở nhiệt độ rất cao, đủ để nhôm khử oxit kim loại. Một ví dụ phổ biến của phản ứng này là phản ứng giữa nhôm và oxit sắt \(Fe_2O_3\), được dùng trong hàn nhiệt nhôm để nối các thanh ray đường sắt.
Ví dụ phương trình phản ứng giữa nhôm và oxit sắt:
\[
Fe_2O_3 + 2Al \rightarrow 2Fe + Al_2O_3
\]
Phản ứng này rất tỏa nhiệt, sản phẩm sắt nóng chảy và có thể đạt nhiệt độ lên tới 2500°C, đủ để nấu chảy và nối liền các thanh kim loại.
Nhờ khả năng tạo ra nhiệt độ cao và sự đơn giản trong việc thực hiện, phản ứng nhiệt nhôm không chỉ được sử dụng trong công nghiệp mà còn là một chủ đề quan trọng trong giáo dục hóa học, giúp học sinh hiểu rõ hơn về quá trình oxi hóa khử và ứng dụng của nó trong thực tiễn.
Phân tích bài toán hóa học liên quan đến phản ứng nhiệt nhôm
Để phân tích một bài toán hóa học liên quan đến phản ứng nhiệt nhôm, chúng ta sẽ đi qua các bước cơ bản dưới đây, từ việc xác định chất tham gia, sản phẩm, đến tính toán lượng chất.
Bài toán
Giả sử chúng ta có một bài toán: "Thực hiện phản ứng nhiệt nhôm hoàn toàn với 3,48 gam oxit FexOy, thu được 2,52 gam kim loại sắt (Fe). Tính khối lượng nhôm đã tham gia phản ứng."
Các bước giải
-
Xác định số mol của sắt thu được:
Để xác định số mol sắt, chúng ta sử dụng công thức:
\[
n_{Fe} = \frac{m_{Fe}}{M_{Fe}} = \frac{2,52 \, \text{g}}{56 \, \text{g/mol}} = 0,045 \, \text{mol}
\] -
Viết phương trình phản ứng:
Phương trình phản ứng nhiệt nhôm giữa FexOy và nhôm Al có dạng:
\[
FexOy + yAl \rightarrow xFe + \frac{y}{2}Al_2O_3
\]Theo phương trình, số mol nhôm tham gia phản ứng sẽ phụ thuộc vào tỷ lệ \(\frac{y}{x}\) của các hệ số trong phương trình.
-
Xác định khối lượng nhôm đã tham gia phản ứng:
Sau khi xác định được số mol nhôm cần thiết, chúng ta có thể tính khối lượng nhôm:
\[
m_{Al} = n_{Al} \times 27 \, \text{g/mol}
\]Với \( n_{Al} \) được tính theo phương trình phản ứng và số mol sắt đã biết.
-
Kết luận:
Cuối cùng, chúng ta sẽ so sánh khối lượng nhôm tính được với dữ liệu bài toán, đưa ra kết luận về lượng nhôm cần thiết và tính hợp lý của quá trình.
Quá trình phân tích bài toán hóa học liên quan đến phản ứng nhiệt nhôm đòi hỏi sự hiểu biết sâu sắc về cân bằng phương trình hóa học, kỹ năng tính toán chính xác và khả năng áp dụng các kiến thức lý thuyết vào thực tế.

Các loại oxit tham gia phản ứng nhiệt nhôm
Trong phản ứng nhiệt nhôm, nhôm (\(Al\)) đóng vai trò là chất khử, tác dụng với nhiều loại oxit kim loại khác nhau để tạo ra kim loại tự do và oxit nhôm (\(Al_2O_3\)). Dưới đây là các loại oxit phổ biến thường tham gia vào phản ứng này:
- Oxit sắt (\(Fe_2O_3\)):
Oxit sắt (\(Fe_2O_3\)) là một trong những oxit kim loại phổ biến nhất được sử dụng trong phản ứng nhiệt nhôm. Phản ứng tạo ra sắt (\(Fe\)) và oxit nhôm (\(Al_2O_3\)). Đây là phản ứng đặc trưng trong quy trình hàn nhiệt nhôm, được sử dụng rộng rãi trong công nghiệp.
Phương trình phản ứng:
\[
Fe_2O_3 + 2Al \rightarrow 2Fe + Al_2O_3
\] - Oxit đồng (\(CuO\)):
Oxit đồng (\(CuO\)) là một oxit kim loại khác có thể tham gia phản ứng nhiệt nhôm, tạo ra đồng kim loại (\(Cu\)) và oxit nhôm. Phản ứng này cũng có tính ứng dụng cao trong công nghiệp luyện kim.
Phương trình phản ứng:
\[
3CuO + 2Al \rightarrow 3Cu + Al_2O_3
\] - Oxit crôm (\(Cr_2O_3\)):
Oxit crôm (\(Cr_2O_3\)) có thể tham gia phản ứng nhiệt nhôm để sản xuất crôm kim loại (\(Cr\)). Phản ứng này thường được sử dụng trong sản xuất crôm kim loại có độ tinh khiết cao.
Phương trình phản ứng:
\[
Cr_2O_3 + 2Al \rightarrow 2Cr + Al_2O_3
\] - Oxit mangan (\(MnO_2\)):
Oxit mangan (\(MnO_2\)) cũng có thể phản ứng với nhôm để tạo ra mangan kim loại (\(Mn\)) và oxit nhôm. Phản ứng này có ý nghĩa quan trọng trong công nghiệp luyện kim.
Phương trình phản ứng:
\[
3MnO_2 + 4Al \rightarrow 3Mn + 2Al_2O_3
\] - Các oxit khác:
Bên cạnh những oxit đã nêu, các oxit kim loại khác như oxit kẽm (\(ZnO\)) và oxit thiếc (\(SnO_2\)) cũng có thể tham gia phản ứng nhiệt nhôm, nhưng ít phổ biến hơn. Chúng tạo ra kim loại tương ứng và oxit nhôm.
Nhìn chung, phản ứng nhiệt nhôm có thể được thực hiện với nhiều loại oxit kim loại khác nhau, tùy thuộc vào mục đích cụ thể của quá trình luyện kim hoặc ứng dụng công nghiệp.

Ứng dụng thực tế của phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm có rất nhiều ứng dụng thực tế trong công nghiệp và đời sống. Dưới đây là một số ứng dụng nổi bật của phản ứng này:
- Hàn nhiệt nhôm:
Phản ứng nhiệt nhôm được sử dụng phổ biến trong quá trình hàn nhiệt, đặc biệt là hàn đường ray tàu hỏa. Phản ứng giữa nhôm và oxit sắt (\(Fe_2O_3\)) tạo ra nhiệt độ rất cao, làm nóng chảy và kết dính các đoạn đường ray lại với nhau. Đây là một phương pháp hàn hiệu quả và có tính kinh tế cao.
- Luyện kim và chiết xuất kim loại:
Phản ứng nhiệt nhôm được sử dụng để chiết xuất kim loại có giá trị cao từ quặng. Ví dụ, nhôm có thể khử oxit crom (\(Cr_2O_3\)) để tạo ra crôm kim loại tinh khiết. Phương pháp này thường được sử dụng trong công nghiệp luyện kim để sản xuất các kim loại đặc biệt.
- Sản xuất vật liệu chịu lửa:
Oxit nhôm (\(Al_2O_3\)) được tạo ra từ phản ứng nhiệt nhôm có tính chất chịu lửa cao và được sử dụng để sản xuất các vật liệu chịu nhiệt, như gạch chịu lửa trong lò luyện kim và lò đốt rác.
- Ứng dụng trong y học:
Trong một số ứng dụng y học, phản ứng nhiệt nhôm được sử dụng để sản xuất các hợp kim đặc biệt dùng trong cấy ghép và chỉnh hình xương. Các hợp kim này có độ bền cao và tương thích tốt với cơ thể con người.
- Thí nghiệm giáo dục:
Phản ứng nhiệt nhôm là một thí nghiệm phổ biến trong giáo dục hóa học, giúp học sinh hiểu rõ hơn về quá trình oxi hóa khử, năng lượng tỏa ra trong phản ứng, và tính ứng dụng thực tế của các phản ứng hóa học.
Nhờ vào khả năng tạo ra nhiệt độ cao và sản phẩm có tính ứng dụng rộng rãi, phản ứng nhiệt nhôm không chỉ quan trọng trong công nghiệp mà còn có giá trị lớn trong nhiều lĩnh vực khác.

Lưu ý khi thực hiện phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là một phản ứng hóa học mạnh mẽ và tỏa ra nhiệt lượng lớn, vì vậy khi thực hiện, cần tuân thủ các lưu ý sau để đảm bảo an toàn và hiệu quả:
- Chuẩn bị và kiểm tra thiết bị:
Trước khi tiến hành, đảm bảo rằng tất cả các thiết bị thí nghiệm, bao gồm dụng cụ đựng và hệ thống làm mát, đều trong tình trạng tốt. Kiểm tra kỹ lưỡng để tránh hỏng hóc trong quá trình thực hiện phản ứng.
- Thực hiện trong môi trường kiểm soát:
Phản ứng nhiệt nhôm nên được thực hiện trong môi trường kiểm soát, như trong lò thí nghiệm hoặc buồng kín, để ngăn ngừa sự phát tán của các sản phẩm phụ nguy hiểm và kiểm soát nhiệt độ hiệu quả.
- Trang bị bảo hộ cá nhân:
Người thực hiện phải được trang bị đầy đủ bảo hộ lao động, bao gồm kính bảo hộ, găng tay chịu nhiệt, và áo khoác phòng thí nghiệm để bảo vệ khỏi nhiệt độ cao và tia lửa phát sinh trong quá trình phản ứng.
- Kiểm soát lượng hóa chất:
Chỉ sử dụng lượng nhôm và oxit kim loại vừa đủ, theo đúng tỷ lệ trong phương trình hóa học để tránh hiện tượng cháy nổ hoặc phản ứng quá mạnh gây nguy hiểm.
- Xử lý sản phẩm sau phản ứng:
Sau khi phản ứng kết thúc, cần để nguội sản phẩm hoàn toàn trước khi xử lý hoặc loại bỏ. Các sản phẩm có thể chứa những chất còn dư thừa, cần được xử lý theo quy định an toàn hóa chất.
- Tuân thủ quy định an toàn:
Trong quá trình thực hiện, luôn tuân thủ các quy định an toàn phòng thí nghiệm, đặc biệt là các quy định liên quan đến xử lý hóa chất nguy hiểm và cháy nổ.
Những lưu ý trên giúp đảm bảo rằng phản ứng nhiệt nhôm được thực hiện một cách an toàn và hiệu quả, đồng thời giảm thiểu nguy cơ tai nạn và hư hỏng thiết bị.