Chủ đề nguyên tử hạt nhân là gì: Nguyên tử hạt nhân là thành phần cốt lõi của mọi vật chất, đóng vai trò quan trọng trong việc xác định tính chất và ứng dụng của các nguyên tố hóa học. Bài viết này sẽ giúp bạn hiểu rõ hơn về cấu trúc, vai trò và những ứng dụng quan trọng của nguyên tử hạt nhân trong cuộc sống và khoa học.
Mục lục
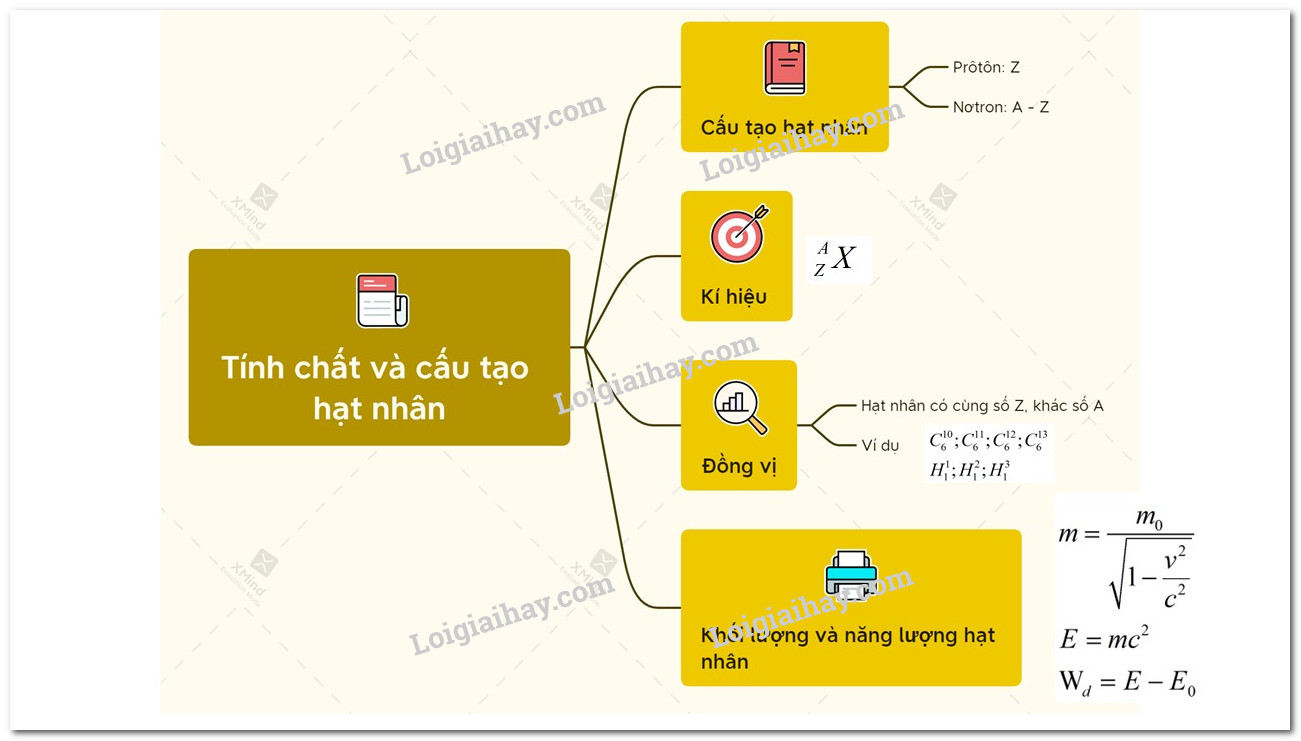
Nguyên tử và Hạt nhân Nguyên tử là gì?
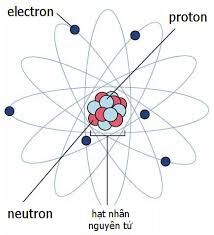
Nguyên tử là đơn vị cơ bản của vật chất, được tạo thành từ ba loại hạt cơ bản là proton, neutron và electron. Trong đó, proton và neutron tập trung tại trung tâm của nguyên tử, tạo thành hạt nhân nguyên tử. Hạt nhân nguyên tử chiếm phần lớn khối lượng của nguyên tử và có vai trò quan trọng trong các tính chất vật lý và hóa học của nguyên tố.
1. Cấu trúc của Nguyên tử
- Proton: Hạt mang điện tích dương (+) và được tìm thấy trong hạt nhân nguyên tử. Số lượng proton xác định số hiệu nguyên tử của nguyên tố.
- Neutron: Hạt không mang điện tích và cũng nằm trong hạt nhân nguyên tử. Neutron giúp ổn định hạt nhân bằng cách giảm lực đẩy giữa các proton.
- Electron: Hạt mang điện tích âm (-) và di chuyển xung quanh hạt nhân trong các lớp vỏ nguyên tử. Electron chịu trách nhiệm cho các phản ứng hóa học và liên kết giữa các nguyên tử.
2. Hạt nhân Nguyên tử
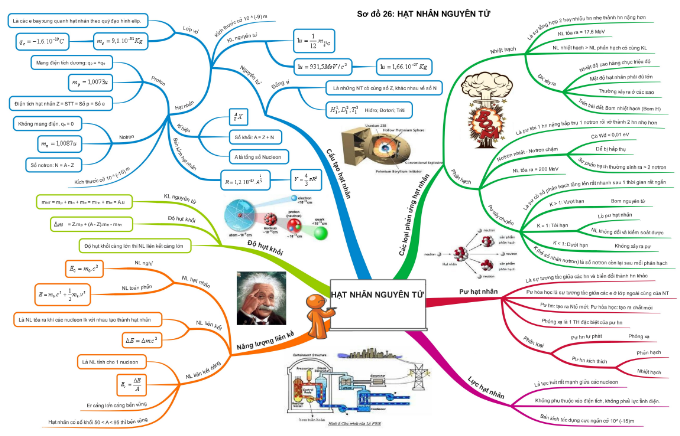
Hạt nhân nguyên tử là phần trung tâm của nguyên tử, gồm các proton và neutron. Kích thước của hạt nhân rất nhỏ so với toàn bộ nguyên tử nhưng chứa gần như toàn bộ khối lượng của nguyên tử.
- Lực hạt nhân mạnh: Lực này giữ các proton và neutron trong hạt nhân, vượt qua lực đẩy điện giữa các proton cùng điện tích.
- Khối lượng và khối lượng nguyên tử: Khối lượng của một nguyên tử chủ yếu do khối lượng của hạt nhân quyết định, vì electron có khối lượng rất nhỏ.
3. Công thức Toán học liên quan đến Nguyên tử và Hạt nhân
- Khối lượng nguyên tử: \[m = Z \cdot m_p + (A-Z) \cdot m_n \] trong đó \(Z\) là số proton, \(A\) là số khối (tổng số proton và neutron), \(m_p\) và \(m_n\) lần lượt là khối lượng của proton và neutron.
- Năng lượng liên kết hạt nhân: \[E = \Delta m \cdot c^2 \] trong đó \(\Delta m\) là độ hụt khối, \(c\) là vận tốc ánh sáng. Công thức này biểu thị năng lượng cần thiết để tách hoàn toàn các hạt trong hạt nhân.
4. Tầm quan trọng của Hạt nhân Nguyên tử trong Hóa học và Vật lý
Hạt nhân nguyên tử đóng vai trò quan trọng trong các tính chất hóa học của nguyên tố. Các phản ứng hạt nhân, như phân rã hạt nhân và phản ứng tổng hợp hạt nhân, có ứng dụng trong nhiều lĩnh vực như năng lượng hạt nhân, y học hạt nhân và nghiên cứu khoa học cơ bản.
5. Các ứng dụng của Nghiên cứu về Nguyên tử và Hạt nhân
Nghiên cứu về cấu trúc và tính chất của nguyên tử và hạt nhân đã dẫn đến nhiều ứng dụng quan trọng, bao gồm:
| 1. Năng lượng hạt nhân | Sử dụng phản ứng phân hạch và nhiệt hạch để sản xuất năng lượng. |
| 2. Y học hạt nhân | Sử dụng đồng vị phóng xạ trong chẩn đoán và điều trị bệnh. |
| 3. Vật lý nguyên tử | Nghiên cứu các nguyên tắc cơ bản của vật lý thông qua các phản ứng hạt nhân. |

.png)
Mục Lục
1. Khái niệm về nguyên tử và hạt nhân
2. Cấu trúc hạt nhân nguyên tử
3. Số hiệu nguyên tử và vai trò của nó
4. Đồng vị và sự khác biệt trong cấu trúc hạt nhân
5. Nguyên tử khối và công thức tính toán
6. Ứng dụng của nguyên tử hạt nhân trong khoa học và công nghệ
7. Các nhà khoa học nổi tiếng nghiên cứu về hạt nhân
Khái niệm cơ bản về nguyên tử và hạt nhân
Nguyên tử là đơn vị cơ bản của vật chất, cấu thành nên mọi vật thể trong vũ trụ. Nguyên tử bao gồm một hạt nhân trung tâm, chứa các proton mang điện tích dương và neutron không mang điện, cùng với các electron mang điện tích âm chuyển động xung quanh hạt nhân.
Hạt nhân nguyên tử, chiếm phần lớn khối lượng của nguyên tử, được cấu tạo từ các proton và neutron. Số lượng proton trong hạt nhân xác định số hiệu nguyên tử của nguyên tố và vị trí của nguyên tố đó trong bảng tuần hoàn.
Ví dụ, nguyên tử của nguyên tố hydro có một proton trong hạt nhân và một electron bên ngoài hạt nhân. Trong khi đó, nguyên tử của nguyên tố oxy có tám proton trong hạt nhân và tám electron chuyển động xung quanh.
Hạt nhân là phần quan trọng nhất của nguyên tử, quyết định tính chất hóa học và vật lý của nguyên tố. Mặc dù electron chiếm phần lớn không gian của nguyên tử, nhưng khối lượng của chúng rất nhỏ so với hạt nhân.

Số hiệu nguyên tử và vai trò của nó
Số hiệu nguyên tử, ký hiệu là \(Z\), là con số biểu thị số lượng proton trong hạt nhân của một nguyên tử. Đây là một trong những thông số quan trọng nhất để xác định đặc tính của nguyên tử và vị trí của nó trong bảng tuần hoàn các nguyên tố.
Số hiệu nguyên tử không chỉ quyết định tính chất hóa học của nguyên tố mà còn xác định cấu trúc điện tử của nguyên tử đó. Vì các electron xung quanh hạt nhân luôn sắp xếp theo quy luật nhất định để đạt trạng thái năng lượng thấp nhất, số lượng electron tương đương với số hiệu nguyên tử trong trường hợp nguyên tử trung hòa.
Ví dụ, với \(Z = 1\), nguyên tử hydro có một proton và một electron duy nhất. Khi \(Z = 8\), nguyên tử oxy có tám proton trong hạt nhân và tám electron xung quanh hạt nhân.
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp dựa trên số hiệu nguyên tử, cho phép dễ dàng phân loại và nghiên cứu các tính chất hóa học và vật lý của các nguyên tố. Số hiệu nguyên tử càng lớn, nguyên tố càng có xu hướng nặng hơn và phức tạp hơn về mặt hóa học.

XEM THÊM:
Cấu trúc hạt nhân nguyên tử
Hạt nhân nguyên tử là thành phần chính của nguyên tử, chiếm phần lớn khối lượng của nguyên tử và chứa các hạt proton và neutron. Proton mang điện tích dương \((+1)\), trong khi neutron không mang điện tích. Hạt nhân được giữ chặt bởi lực hạt nhân mạnh, một trong bốn lực cơ bản trong tự nhiên.
Mỗi nguyên tử có số lượng proton khác nhau, được gọi là số hiệu nguyên tử \(Z\), xác định loại nguyên tố. Ví dụ, nguyên tử hydro có một proton trong hạt nhân, trong khi nguyên tử oxy có tám proton.
Neutron, mặc dù không mang điện, có vai trò quan trọng trong việc ổn định hạt nhân. Số lượng neutron trong hạt nhân có thể thay đổi, tạo ra các đồng vị khác nhau của cùng một nguyên tố. Đồng vị là các biến thể của nguyên tố có cùng số lượng proton nhưng khác nhau về số lượng neutron.
Kích thước của hạt nhân rất nhỏ so với toàn bộ nguyên tử, với bán kính chỉ vào khoảng \(10^{-15}\) mét, trong khi bán kính của nguyên tử khoảng \(10^{-10}\) mét. Mặc dù nhỏ, hạt nhân chứa gần như toàn bộ khối lượng của nguyên tử, do proton và neutron đều có khối lượng đáng kể so với electron.
Hạt nhân nguyên tử cũng là nơi xảy ra các phản ứng hạt nhân như phân hạch (fission) và nhiệt hạch (fusion), những phản ứng này giải phóng năng lượng rất lớn và là cơ sở cho cả năng lượng hạt nhân và vũ khí hạt nhân.

Đồng vị và ứng dụng của chúng
Đồng vị là những biến thể của một nguyên tố hóa học, có cùng số proton nhưng khác nhau về số neutron trong hạt nhân. Điều này dẫn đến sự khác biệt về khối lượng nguyên tử, mặc dù chúng có cùng số hiệu nguyên tử và thuộc cùng một nguyên tố. Đồng vị có thể là tự nhiên hoặc nhân tạo, và chúng đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ.
Một số đồng vị tự nhiên nổi tiếng bao gồm Carbon-12 và Carbon-14. Trong đó, Carbon-14 được sử dụng phổ biến trong phương pháp xác định niên đại bằng carbon, giúp các nhà khoa học xác định tuổi của các mẫu vật cổ đại. Đồng vị nhân tạo như Iodine-131 được sử dụng trong y học để điều trị các bệnh liên quan đến tuyến giáp.
Các đồng vị còn được ứng dụng trong nhiều lĩnh vực khác như:
- Y học: Đồng vị phóng xạ như Technetium-99m được sử dụng trong hình ảnh y khoa để chẩn đoán nhiều bệnh lý.
- Nông nghiệp: Đồng vị được sử dụng để cải thiện năng suất cây trồng và kiểm soát sâu bệnh.
- Công nghiệp: Đồng vị phóng xạ được sử dụng trong kiểm tra không phá hủy và theo dõi dòng chảy của các chất lỏng trong hệ thống công nghiệp.
- Khoa học: Đồng vị giúp nghiên cứu về sự phân hủy hạt nhân và các phản ứng hóa học phức tạp.
Ứng dụng của đồng vị trong đời sống đã mang lại nhiều lợi ích to lớn, từ việc cải thiện sức khỏe con người đến thúc đẩy sự phát triển của công nghệ và nghiên cứu khoa học.
Cách tính toán nguyên tử khối
Nguyên tử khối là khối lượng của một nguyên tử tính theo đơn vị khối lượng nguyên tử (amu). Nguyên tử khối trung bình của một nguyên tố được tính dựa trên tỉ lệ phần trăm của các đồng vị và khối lượng của chúng.
Công thức tính toán nguyên tử khối trung bình của một nguyên tố hóa học được xác định bằng cách lấy tổng tích của tỉ lệ phần trăm từng đồng vị với khối lượng của chúng:
Ví dụ, để tính nguyên tử khối trung bình của Clo (\(Cl\)), chúng ta xem xét hai đồng vị chính là \(Cl-35\) và \(Cl-37\):
- Khối lượng của \(Cl-35\) là 34.969 amu và tỉ lệ chiếm 75.77%
- Khối lượng của \(Cl-37\) là 36.966 amu và tỉ lệ chiếm 24.23%
Sử dụng công thức trên:
Đây là cách tính toán nguyên tử khối của một nguyên tố dựa trên các đồng vị và tỉ lệ phần trăm của chúng.