Chủ đề năng lượng ion hóa: Năng lượng ion hóa là yếu tố quyết định trong việc hiểu rõ cấu trúc và tính chất của các nguyên tố hóa học. Bài viết này sẽ cung cấp kiến thức tổng quan về khái niệm này, cách tính toán, cũng như những ứng dụng quan trọng trong khoa học và công nghệ hiện đại.
Mục lục
Năng Lượng Ion Hóa
Năng lượng ion hóa là một khái niệm quan trọng trong hóa học, đại diện cho lượng năng lượng cần thiết để loại bỏ một electron khỏi nguyên tử hoặc phân tử ở trạng thái cơ bản. Điều này liên quan chặt chẽ đến cấu trúc điện tử của nguyên tử và ảnh hưởng đến nhiều tính chất hóa học của các nguyên tố.
Năng Lượng Ion Hóa Đầu Tiên
Năng lượng ion hóa đầu tiên là năng lượng cần thiết để loại bỏ electron đầu tiên khỏi nguyên tử khi nó đang ở trạng thái cơ bản. Ký hiệu của năng lượng ion hóa đầu tiên thường được biểu diễn là \(I_1\).
Năng Lượng Ion Hóa Thứ N
Khi tiếp tục loại bỏ các electron tiếp theo sau khi đã loại bỏ các electron trước đó, ta có năng lượng ion hóa thứ \(n\). Ký hiệu của năng lượng ion hóa thứ \(n\) được biểu diễn là \(I_n\). Năng lượng ion hóa có đơn vị là kJ/mol.
Các Yếu Tố Ảnh Hưởng Đến Năng Lượng Ion Hóa
- Khoảng cách từ electron đến hạt nhân: Electron càng gần hạt nhân thì năng lượng ion hóa càng cao do lực hút giữa electron và hạt nhân mạnh hơn.
- Số lượng electron trong lớp vỏ: Khi số electron trong lớp vỏ tăng lên, năng lượng ion hóa của các electron bên ngoài giảm do hiệu ứng chắn.
- Cấu hình electron: Các nguyên tố có cấu hình electron ổn định (ví dụ như các nguyên tố khí hiếm) có năng lượng ion hóa cao hơn do cần nhiều năng lượng hơn để phá vỡ sự ổn định này.
Ví Dụ Về Năng Lượng Ion Hóa
So sánh giữa hai nguyên tố Kali (K) và Natri (Na): Kali có cấu hình electron là [Ar]4s1 trong khi Natri có cấu hình là [Ne]3s1. Do Natri có ít lớp electron hơn, lực hút giữa hạt nhân và electron ngoài cùng mạnh hơn, do đó năng lượng ion hóa của Natri lớn hơn so với Kali.
Kết Luận
Năng lượng ion hóa là một đại lượng quan trọng giúp hiểu rõ hơn về tính chất hóa học của các nguyên tố. Việc so sánh năng lượng ion hóa của các nguyên tố khác nhau giúp chúng ta dự đoán được khả năng phản ứng của chúng trong các phản ứng hóa học.
.png)
1. Khái Niệm và Định Nghĩa
Năng lượng ion hóa là khái niệm quan trọng trong hóa học và vật lý, thể hiện năng lượng tối thiểu cần thiết để loại bỏ một electron ra khỏi nguyên tử hoặc phân tử ở trạng thái khí. Đây là quá trình mà nguyên tử hoặc phân tử chuyển từ trạng thái trung hòa sang trạng thái ion dương. Năng lượng ion hóa thường được ký hiệu là \(I_n\), trong đó \(n\) biểu thị thứ tự của electron bị loại bỏ. Đơn vị đo lường phổ biến cho năng lượng ion hóa là kilojoule trên mol (kJ/mol).
- Năng lượng ion hóa đầu tiên: Năng lượng cần để loại bỏ electron đầu tiên.
- Năng lượng ion hóa thứ n: Năng lượng cần để loại bỏ electron thứ n sau khi các electron trước đó đã bị loại bỏ.
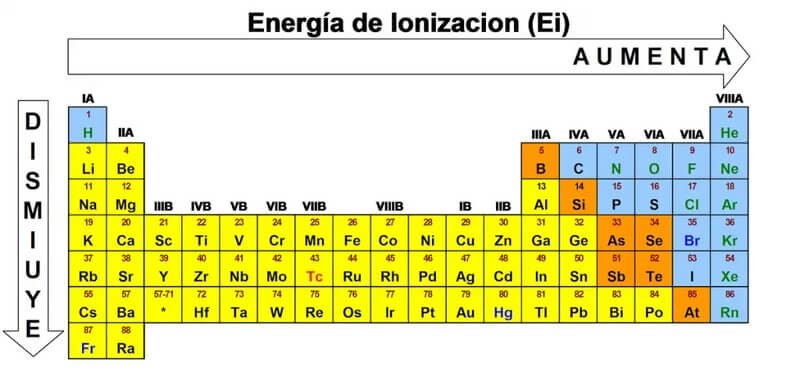
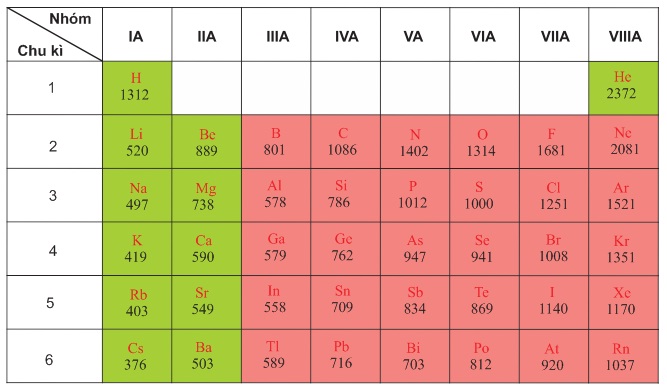
Năng lượng ion hóa có xu hướng tăng lên khi tiến từ trái sang phải trong cùng một chu kỳ của bảng tuần hoàn do lực hút giữa hạt nhân và electron tăng lên. Ngược lại, năng lượng ion hóa giảm dần từ trên xuống dưới trong cùng một nhóm do khoảng cách giữa electron ngoài cùng và hạt nhân tăng, làm giảm lực hút này.
Ví dụ, nguyên tố kali (K) và natri (Na) có cấu hình electron khác nhau, dẫn đến giá trị năng lượng ion hóa khác nhau, trong đó kali có năng lượng ion hóa thấp hơn do có nhiều lớp electron hơn, dẫn đến lực hút yếu hơn giữa hạt nhân và electron ngoài cùng.
2. Phân Loại Năng Lượng Ion Hóa
Năng lượng ion hóa có thể được phân loại dựa trên thứ tự của các electron bị loại bỏ từ nguyên tử hoặc phân tử. Dưới đây là các loại năng lượng ion hóa chính:
- Năng lượng ion hóa đầu tiên (\(I_1\)): Đây là năng lượng cần thiết để loại bỏ electron đầu tiên khỏi nguyên tử, chuyển nó từ trạng thái trung hòa sang trạng thái ion dương với một đơn vị điện tích (+1). Đây là loại năng lượng quan trọng nhất và được nghiên cứu phổ biến nhất.
- Năng lượng ion hóa thứ hai (\(I_2\)): Sau khi electron đầu tiên đã bị loại bỏ, năng lượng ion hóa thứ hai là năng lượng cần để loại bỏ electron thứ hai, tiếp tục tăng điện tích dương của ion lên +2. Năng lượng này thường lớn hơn so với năng lượng ion hóa đầu tiên do lực hút giữa electron còn lại và hạt nhân mạnh hơn.
- Năng lượng ion hóa thứ n (\(I_n\)): Năng lượng ion hóa thứ n áp dụng cho electron thứ n, tiếp tục quá trình loại bỏ electron từ nguyên tử hoặc ion đã bị ion hóa trước đó. Giá trị của năng lượng này tăng dần theo thứ tự loại bỏ electron do lực hút giữa hạt nhân và các electron còn lại càng mạnh.
Thông thường, năng lượng ion hóa đầu tiên có giá trị nhỏ nhất, và giá trị này sẽ tăng dần khi tiếp tục loại bỏ các electron tiếp theo. Điều này là do sự giảm số lượng electron, làm tăng lực hút của hạt nhân đối với các electron còn lại.

3. Ảnh Hưởng của Năng Lượng Ion Hóa
Năng lượng ion hóa đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và kỹ thuật. Ảnh hưởng của nó có thể thấy rõ qua các yếu tố sau:
- Ảnh hưởng đến tính chất hóa học: Năng lượng ion hóa ảnh hưởng trực tiếp đến khả năng phản ứng của các nguyên tố. Các nguyên tố có năng lượng ion hóa thấp dễ mất electron hơn, khiến chúng trở nên hoạt động mạnh mẽ hơn trong các phản ứng hóa học, đặc biệt là các phản ứng tạo ion dương.
- Ảnh hưởng đến liên kết hóa học: Năng lượng ion hóa cũng quyết định độ bền của liên kết trong các hợp chất ion. Ví dụ, trong hợp chất NaCl, năng lượng ion hóa của natri thấp làm cho nó dễ dàng mất electron, hình thành ion Na+ và tạo liên kết ion với Cl-.
- Ảnh hưởng đến trạng thái vật lý: Năng lượng ion hóa còn ảnh hưởng đến tính chất vật lý của nguyên tố, chẳng hạn như điểm sôi, điểm nóng chảy và độ dẫn điện. Nguyên tố có năng lượng ion hóa cao thường có cấu trúc nguyên tử chặt chẽ hơn, dẫn đến điểm nóng chảy và sôi cao hơn.
- Ảnh hưởng đến phân loại nguyên tố: Trên bảng tuần hoàn, năng lượng ion hóa là một trong những yếu tố giúp phân loại nguyên tố, từ kim loại kiềm có năng lượng ion hóa thấp đến các khí hiếm với năng lượng ion hóa cao.
Những ảnh hưởng này cho thấy vai trò quan trọng của năng lượng ion hóa trong việc xác định đặc tính và ứng dụng của các nguyên tố trong thực tế.

4. Các Ví Dụ Cụ Thể
Dưới đây là một số ví dụ cụ thể minh họa cho năng lượng ion hóa và cách nó ảnh hưởng đến các nguyên tố và hợp chất khác nhau:
- Ví dụ 1: Năng lượng ion hóa của Hydro
Hydro là nguyên tố đơn giản nhất với một electron duy nhất. Năng lượng ion hóa của hydro là 13.6 eV. Điều này có nghĩa là cần 13.6 eV để loại bỏ electron khỏi nguyên tử hydro, chuyển nó thành ion H+. Năng lượng ion hóa cao này giải thích tại sao hydro tồn tại chủ yếu ở dạng phân tử H2 thay vì ion.
- Ví dụ 2: Năng lượng ion hóa của Natri
Natri có năng lượng ion hóa đầu tiên là 5.14 eV, thấp hơn nhiều so với hydro. Điều này cho thấy natri dễ dàng mất electron hơn để tạo thành ion Na+, góp phần vào tính chất phản ứng mạnh mẽ của nó trong các phản ứng hóa học, như khi tạo thành muối ăn (NaCl) với clo.
- Ví dụ 3: Năng lượng ion hóa của Helium
Helium có năng lượng ion hóa rất cao, khoảng 24.6 eV, vì nó có cấu trúc electron bền vững với đầy đủ các lớp vỏ electron. Điều này giải thích tại sao helium rất trơ và ít tham gia vào các phản ứng hóa học.
- Ví dụ 4: Dãy năng lượng ion hóa của Nhóm 1
Các nguyên tố thuộc nhóm 1 của bảng tuần hoàn, như lithium, natri, và kali, có năng lượng ion hóa thấp. Điều này làm cho chúng dễ mất electron và tạo thành các ion dương, dẫn đến tính chất hoạt động hóa học mạnh mẽ của chúng trong các phản ứng, đặc biệt là trong phản ứng với nước.
Các ví dụ trên giúp làm rõ cách năng lượng ion hóa ảnh hưởng đến đặc tính và phản ứng của các nguyên tố trong tự nhiên và các hợp chất hóa học.

5. Tính Toán và Đo Lường Năng Lượng Ion Hóa
Năng lượng ion hóa là một khái niệm quan trọng trong hóa học và vật lý, được sử dụng để đo lường mức độ khó khăn trong việc loại bỏ một electron ra khỏi nguyên tử hoặc phân tử. Để tính toán và đo lường năng lượng ion hóa, các phương pháp và công thức cụ thể được áp dụng.
- Phương trình Rydberg
Phương trình Rydberg được sử dụng để tính toán năng lượng ion hóa của các nguyên tử hydro. Công thức tổng quát như sau:
$$ E_n = - \frac{R_H \cdot hc}{n^2} $$
Trong đó:
- \\( E_n \\): năng lượng của electron ở mức n
- \\( R_H \\): hằng số Rydberg (1.097 x 10^7 m^{-1})
- \\( h \\): hằng số Planck
- \\( c \\): tốc độ ánh sáng
- \\( n \\): mức lượng tử
- Phương pháp thực nghiệm
Năng lượng ion hóa cũng có thể được xác định thông qua các thí nghiệm, sử dụng các thiết bị như quang phổ kế khối (mass spectrometer) hoặc phổ kế quang điện (photoelectron spectrometer). Các bước cơ bản bao gồm:
- Chiếu tia tử ngoại hoặc tia X vào mẫu.
- Đo lường năng lượng của các electron bị tách ra khỏi nguyên tử.
- Sử dụng các dữ liệu này để tính toán năng lượng ion hóa cần thiết để loại bỏ electron.
- Bảng năng lượng ion hóa
Các nhà khoa học thường sử dụng bảng năng lượng ion hóa để tra cứu giá trị năng lượng ion hóa của các nguyên tố. Dưới đây là ví dụ về một số nguyên tố:
Nguyên tố Năng lượng ion hóa đầu tiên (eV) Hydro (H) 13.6 Helium (He) 24.6 Lithium (Li) 5.39 Berili (Be) 9.32
Việc hiểu rõ và tính toán chính xác năng lượng ion hóa không chỉ giúp nắm bắt được tính chất hóa học của các nguyên tố, mà còn đóng vai trò quan trọng trong việc nghiên cứu và ứng dụng trong các lĩnh vực khoa học và công nghệ.
XEM THÊM:
6. Liên Hệ Giữa Năng Lượng Ion Hóa và Cấu Trúc Nguyên Tử
Năng lượng ion hóa là một chỉ số quan trọng phản ánh mối quan hệ giữa năng lượng cần thiết để tách một electron ra khỏi nguyên tử và cấu trúc của nguyên tử đó. Hiểu rõ mối liên hệ này giúp làm sáng tỏ nhiều khía cạnh của hóa học và vật lý nguyên tử.
- Cấu trúc lớp vỏ electron
Nguyên tử được cấu tạo từ các lớp vỏ electron xung quanh hạt nhân. Các electron ở lớp ngoài cùng (lớp hóa trị) là những electron có năng lượng thấp nhất để bị tách ra. Năng lượng ion hóa thường giảm dần từ trên xuống dưới trong cùng một nhóm trên bảng tuần hoàn do khoảng cách giữa electron lớp ngoài cùng và hạt nhân tăng lên.
- Điện tích hạt nhân hiệu dụng
Điện tích hạt nhân hiệu dụng (Zeff) là lực hút mà electron cảm nhận được từ hạt nhân, đã được giảm thiểu do sự chắn bởi các electron khác. Zeff càng cao thì năng lượng ion hóa càng lớn, do lực hút mạnh hơn giữa hạt nhân và electron cần tách ra.
- Sự bất thường trong bảng tuần hoàn
Một số nguyên tố có giá trị năng lượng ion hóa cao bất thường do cấu hình electron đặc biệt bền vững, chẳng hạn như các nguyên tố khí hiếm. Điều này dẫn đến các sự biến đổi trong cấu trúc bảng tuần hoàn, làm nổi bật tầm quan trọng của cấu trúc nguyên tử đối với năng lượng ion hóa.
Hiểu rõ mối liên hệ giữa năng lượng ion hóa và cấu trúc nguyên tử là nền tảng để giải thích nhiều hiện tượng hóa học và dự đoán tính chất của các nguyên tố, đóng góp lớn vào sự phát triển của khoa học nguyên tử.
7. Ứng Dụng Thực Tiễn
Năng lượng ion hóa không chỉ là một khái niệm lý thuyết mà còn có rất nhiều ứng dụng thực tiễn trong hóa học, vật lý và công nghệ. Dưới đây là một số ứng dụng tiêu biểu:
7.1. Ứng dụng trong hóa học phân tích
Trong hóa học phân tích, năng lượng ion hóa được sử dụng để xác định thành phần và tính chất của các nguyên tố và hợp chất:
- Sử dụng trong máy quang phổ khối (Mass Spectrometry): Năng lượng ion hóa giúp phân tích cấu trúc phân tử bằng cách tách các ion theo khối lượng của chúng.
- Xác định các nguyên tố trong hợp chất: Nhờ sự khác nhau về năng lượng ion hóa, các nguyên tố có thể được nhận diện chính xác trong hợp chất phức tạp.
7.2. Ứng dụng trong vật lý và công nghệ
Năng lượng ion hóa đóng vai trò quan trọng trong nhiều lĩnh vực vật lý và công nghệ hiện đại:
- Phát triển vật liệu mới: Hiểu biết về năng lượng ion hóa giúp các nhà khoa học phát triển các vật liệu với đặc tính cụ thể, như chất bán dẫn trong điện tử học.
- Ứng dụng trong công nghệ năng lượng: Các thiết bị như pin mặt trời hoặc pin nhiên liệu dựa vào hiểu biết về năng lượng ion hóa để tối ưu hóa hiệu suất chuyển đổi năng lượng.
Những ứng dụng này minh chứng rằng năng lượng ion hóa không chỉ giới hạn trong phòng thí nghiệm mà còn ảnh hưởng sâu rộng đến các công nghệ và sản phẩm chúng ta sử dụng hàng ngày.

8. Kết Luận
Năng lượng ion hóa là một trong những yếu tố quan trọng giúp hiểu rõ hơn về cấu trúc nguyên tử và các tính chất hóa học của nguyên tố. Qua việc phân tích các yếu tố ảnh hưởng và ứng dụng của năng lượng ion hóa, chúng ta có thể thấy rõ vai trò quan trọng của nó trong việc giải thích các hiện tượng hóa học và lý giải sự khác biệt giữa các nguyên tố.
Trong bối cảnh khoa học hiện đại, năng lượng ion hóa không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tiễn. Các phương pháp đo lường và tính toán năng lượng ion hóa đã được phát triển, góp phần vào việc nghiên cứu và ứng dụng trong các lĩnh vực như hóa học phân tích, công nghệ và vật lý.
Với sự tiến bộ của khoa học và công nghệ, các nghiên cứu về năng lượng ion hóa sẽ tiếp tục mở ra những hướng đi mới, giúp con người hiểu sâu hơn về thế giới vi mô, từ đó phát triển các ứng dụng hữu ích trong đời sống và công nghiệp.
Tóm lại, việc nghiên cứu và ứng dụng năng lượng ion hóa không chỉ giúp mở rộng kiến thức về khoa học nguyên tử mà còn mang lại những giá trị thực tiễn to lớn trong nhiều lĩnh vực khác nhau, từ hóa học, vật lý đến công nghệ hiện đại.