Chủ đề hệ số nhiệt độ van't hoff: Hệ số nhiệt độ Van't Hoff là một công cụ quan trọng trong việc dự đoán sự biến đổi của phản ứng hóa học khi thay đổi nhiệt độ. Bài viết này sẽ khám phá chi tiết khái niệm, công thức, ý nghĩa và ứng dụng của hệ số này trong nghiên cứu và sản xuất công nghiệp, giúp bạn hiểu rõ hơn về vai trò của nhiệt độ trong các quá trình hóa học.
Mục lục
Hệ Số Nhiệt Độ Van't Hoff: Khái Niệm và Ứng Dụng
Hệ số nhiệt độ Van't Hoff là một khái niệm quan trọng trong hóa học, mô tả sự biến đổi của hằng số cân bằng phản ứng dưới tác động của sự thay đổi nhiệt độ. Quy tắc này giúp dự đoán hướng đi của phản ứng khi nhiệt độ thay đổi, qua đó điều chỉnh và kiểm soát các quá trình hóa học một cách hiệu quả.
Công Thức Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff được biểu diễn bằng công thức:
\[
\ln\left(\frac{K_2}{K_1}\right) = \frac{\Delta H}{R} \left(\frac{1}{T_1} - \frac{1}{T_2}\right)
\]
Trong đó:
- \(K_1\) và \(K_2\) là hằng số cân bằng tại nhiệt độ \(T_1\) và \(T_2\).
- \(\Delta H\) là sự thay đổi enthalpy của phản ứng.
- \(R\) là hằng số khí lý tưởng.
- \(T_1\) và \(T_2\) là nhiệt độ ban đầu và cuối của phản ứng.
Ý Nghĩa Của Hệ Số Nhiệt Độ Van't Hoff
Giá trị của hệ số nhiệt độ Van't Hoff cho biết mức độ nhạy cảm của cân bằng phản ứng đối với nhiệt độ:
- Nếu hệ số nhiệt độ Van't Hoff dương, phản ứng là phản ứng thu nhiệt, nghĩa là cần nhiệt để xảy ra.
- Nếu hệ số nhiệt độ Van't Hoff âm, phản ứng là phản ứng tỏa nhiệt, nghĩa là tự phát và cung cấp nhiệt.
Ứng Dụng Của Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff được áp dụng rộng rãi trong nghiên cứu và thực nghiệm hóa học để dự đoán hướng đi của phản ứng khi nhiệt độ thay đổi. Điều này đặc biệt quan trọng trong công nghiệp, nơi kiểm soát tốc độ phản ứng và hiệu suất là yếu tố quyết định.
- Trong sản xuất công nghiệp, việc kiểm soát nhiệt độ giúp tối ưu hóa hiệu suất phản ứng và giảm thiểu chi phí năng lượng.
- Trong nghiên cứu khoa học, hệ số này giúp xác định các điều kiện lý tưởng cho các phản ứng hóa học phức tạp.
Giới Hạn Và Hạn Chế
Mặc dù hệ số nhiệt độ Van't Hoff rất hữu ích, nhưng nó cũng có những giới hạn:
- Giả định rằng \(\Delta H\) là không đổi, điều này có thể không chính xác trong một số trường hợp, chẳng hạn như khi có sự thay đổi pha.
- Không xét đến các yếu tố khác như áp suất và trạng thái pha, những yếu tố này có thể ảnh hưởng lớn đến hằng số cân bằng và sự thay đổi nhiệt độ.
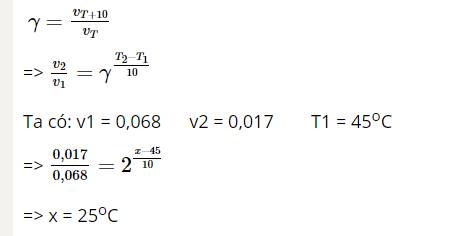
.png)
Tổng Quan Về Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff là một khái niệm quan trọng trong hóa học, đặc biệt trong lĩnh vực nhiệt động lực học. Nó mô tả mối quan hệ giữa hằng số cân bằng của một phản ứng hóa học và nhiệt độ. Hệ số này được đặt tên theo nhà hóa học người Hà Lan Jacobus Henricus van 't Hoff, người đã có những đóng góp quan trọng cho lĩnh vực này.
Công thức Van't Hoff cho biết cách mà hằng số cân bằng (\(K\)) thay đổi khi nhiệt độ (\(T\)) thay đổi. Công thức được biểu diễn dưới dạng:
\[
\ln\left(\frac{K_2}{K_1}\right) = \frac{\Delta H}{R} \left(\frac{1}{T_1} - \frac{1}{T_2}\right)
\]
Trong đó:
- \(K_1\) và \(K_2\) là hằng số cân bằng tại nhiệt độ \(T_1\) và \(T_2\) tương ứng.
- \(\Delta H\) là sự thay đổi enthalpy của phản ứng, thường được coi là không đổi trong một khoảng nhiệt độ nhỏ.
- \(R\) là hằng số khí lý tưởng.
Ý nghĩa của hệ số nhiệt độ Van't Hoff là giúp dự đoán hướng đi của phản ứng khi nhiệt độ thay đổi. Nếu \(\Delta H\) dương, hằng số cân bằng \(K\) tăng khi nhiệt độ tăng, chỉ ra rằng phản ứng thuận là phản ứng thu nhiệt. Ngược lại, nếu \(\Delta H\) âm, \(K\) giảm khi nhiệt độ tăng, phản ứng thuận là phản ứng tỏa nhiệt.
Việc hiểu rõ hệ số nhiệt độ Van't Hoff giúp các nhà hóa học và kỹ sư kiểm soát các điều kiện phản ứng, tối ưu hóa hiệu suất và hiệu quả trong các quá trình công nghiệp, nghiên cứu khoa học, và cả trong môi trường học thuật.
Giới Hạn Và Hạn Chế Của Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff là một khái niệm quan trọng trong hóa học, nhưng nó không phải là không có giới hạn và hạn chế. Dưới đây là một số điểm cần lưu ý:
-
Giới hạn trong phạm vi nhiệt độ:
Hệ số Van't Hoff được áp dụng hiệu quả trong khoảng nhiệt độ không quá cao. Khi nhiệt độ vượt qua một ngưỡng nhất định, sự thay đổi của tốc độ phản ứng không còn tuân theo biểu thức Van't Hoff một cách chính xác, điều này do các yếu tố khác như sự phân hủy hoặc sự thay đổi trạng thái của các chất tham gia phản ứng.
-
Phụ thuộc vào loại phản ứng:
Không phải tất cả các phản ứng hóa học đều tuân theo quy luật Van't Hoff. Hệ số này chỉ áp dụng tốt cho các phản ứng đồng thể đơn giản. Đối với các phản ứng phức tạp, có nhiều bước trung gian hoặc liên quan đến các yếu tố khác như xúc tác, hệ số này có thể không còn phù hợp.
-
Giả định về sự ổn định của các yếu tố khác:
Van't Hoff giả định rằng ngoài nhiệt độ, các yếu tố khác như áp suất và nồng độ không thay đổi. Trong thực tế, khi các yếu tố này biến động, việc áp dụng hệ số Van't Hoff có thể dẫn đến sai lệch lớn trong dự đoán tốc độ phản ứng.
-
Sự ảnh hưởng của liên kết hóa học:
Đối với những phản ứng mà liên kết hydrogen hoặc tương tác van der Waals đóng vai trò quan trọng, sự thay đổi nhiệt độ có thể ảnh hưởng lớn đến cấu trúc và tính chất của các chất, làm cho hệ số Van't Hoff không còn chính xác.
Vì vậy, mặc dù hệ số nhiệt độ Van't Hoff là một công cụ hữu ích để dự đoán sự thay đổi của tốc độ phản ứng theo nhiệt độ, nó cần được sử dụng một cách cẩn trọng và chỉ trong những điều kiện thích hợp.

Các Ví Dụ Cụ Thể Về Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff, ký hiệu là \(\gamma\), là một yếu tố quan trọng để xác định mức độ thay đổi tốc độ phản ứng khi nhiệt độ thay đổi. Dưới đây là một số ví dụ minh họa cụ thể:
- Khi nhiệt độ của một phản ứng tăng thêm \(10^{\circ}C\), tốc độ phản ứng có thể tăng lên từ 2 đến 4 lần. Ví dụ, nếu một phản ứng có tốc độ ban đầu \(v_1\) ở nhiệt độ \(T_1\), khi nhiệt độ tăng lên \(T_2\), tốc độ mới \(v_2\) sẽ được tính theo công thức: \[ \frac{v_2}{v_1} = \gamma^{\frac{T_2 - T_1}{10}} \]
- Ví dụ cụ thể: Một phản ứng có hệ số nhiệt độ Van't Hoff \(\gamma = 2\). Khi nhiệt độ tăng từ \(20^{\circ}C\) lên \(70^{\circ}C\), tốc độ phản ứng tăng lên như sau: \[ v_2 = v_1 \times 2^{\frac{70 - 20}{10}} = v_1 \times 2^5 = v_1 \times 32 \] Điều này cho thấy tốc độ phản ứng tăng gấp 32 lần khi nhiệt độ tăng thêm \(50^{\circ}C\).
- Hệ số nhiệt độ Van't Hoff cũng được áp dụng trong sinh học để tính toán sự thay đổi trong các quá trình sinh học khi nhiệt độ môi trường thay đổi. Ví dụ, tốc độ trao đổi chất ở một số sinh vật có thể tăng gấp đôi khi nhiệt độ tăng thêm \(10^{\circ}C\), tương ứng với hệ số \(\gamma = 2\).

XEM THÊM:
Phân Tích Sâu Về Tầm Quan Trọng Của Hệ Số Nhiệt Độ Van't Hoff
Hệ số nhiệt độ Van't Hoff (\(\gamma\)) là một đại lượng quan trọng trong hóa học, dùng để mô tả sự thay đổi tốc độ phản ứng hóa học khi nhiệt độ thay đổi. Công thức của hệ số này được biểu diễn như sau:
Trong đó:
- \(k_1\) và \(k_2\) lần lượt là tốc độ phản ứng ở hai nhiệt độ khác nhau \(T_1\) và \(T_2\).
Hệ số Van't Hoff có tầm quan trọng lớn trong việc dự đoán và kiểm soát tốc độ phản ứng trong nhiều quá trình công nghiệp và sinh học. Khi nhiệt độ tăng, tốc độ phản ứng thường tăng lên, điều này có thể được giải thích thông qua lý thuyết va chạm và sự gia tăng năng lượng của các phân tử tham gia phản ứng.
Đặc biệt, quy tắc Van't Hoff chỉ áp dụng chính xác trong khoảng nhiệt độ không quá cao. Ứng dụng của hệ số này còn mở rộng sang nhiều lĩnh vực, từ sản xuất hóa chất đến nghiên cứu y sinh, nơi kiểm soát nhiệt độ là yếu tố then chốt để tối ưu hóa hiệu suất của các quá trình.
Một ví dụ cụ thể là khi xét tốc độ phân hủy của một chất xúc tác ở hai nhiệt độ khác nhau, việc tăng nhiệt độ sẽ làm tăng tốc độ phân hủy theo quy tắc Van't Hoff, giúp dự đoán được hiệu quả và độ bền của chất xúc tác trong quá trình sản xuất.