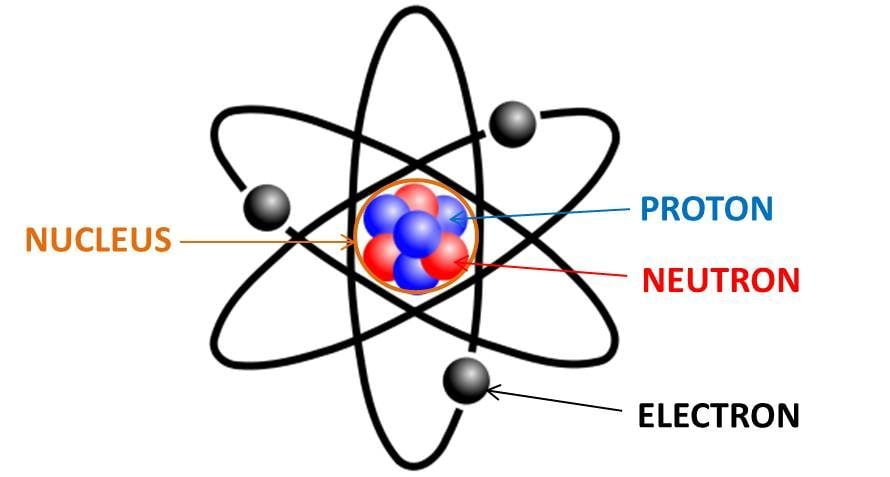
Chủ đề cách xác định số proton nơtron electron: Bài viết này sẽ hướng dẫn bạn cách xác định số proton, nơtron, và electron trong các nguyên tử một cách dễ dàng và chính xác. Đây là kiến thức nền tảng quan trọng trong hóa học và sẽ giúp bạn hiểu rõ hơn về cấu trúc của nguyên tử, cũng như ứng dụng thực tiễn trong các bài tập và nghiên cứu khoa học.
Mục lục
- Cách Xác Định Số Proton, Nơtron, Electron Trong Nguyên Tử
- 1. Khái niệm cơ bản về các hạt proton, nơtron, và electron
- 2. Công thức và cách xác định số proton, nơtron, electron
- 3. Liên hệ giữa số proton, nơtron, electron trong các đồng vị
- 4. Ứng dụng của việc xác định số proton, nơtron, electron
- 5. Bài tập áp dụng
- 6. Tổng kết
Cách Xác Định Số Proton, Nơtron, Electron Trong Nguyên Tử
Trong hóa học, việc xác định số proton, nơtron và electron của một nguyên tử là cơ bản để hiểu cấu trúc nguyên tử và tính chất hóa học của nguyên tố đó. Dưới đây là các bước để xác định:
1. Xác định Số Proton (Z)
Số proton của một nguyên tử được xác định bằng số thứ tự của nguyên tố đó trong bảng tuần hoàn. Số proton cũng chính là số điện tích hạt nhân.
Ví dụ: Nguyên tố Lithium có số proton là 3, vì nó nằm ở vị trí số 3 trong bảng tuần hoàn.
2. Xác định Số Nơtron (N)
Số nơtron được tính bằng cách lấy số khối (A) trừ đi số proton (Z).
- \( N = A - Z \)
Trong đó, số khối (A) là tổng số proton và nơtron trong hạt nhân.
Ví dụ: Đối với nguyên tố Lithium, có số khối là 7 và số proton là 3, số nơtron sẽ là:
- \( N = 7 - 3 = 4 \)
3. Xác định Số Electron
Số electron trong một nguyên tử trung hòa về điện tích sẽ bằng với số proton.
Ví dụ: Đối với nguyên tố Lithium, số proton là 3, do đó số electron cũng sẽ là 3.
4. Ví Dụ Cụ Thể
| Nguyên Tố | Số Proton (Z) | Số Nơtron (N) | Số Electron | Số Khối (A) |
| Lithium | 3 | 4 | 3 | 7 |
| Fluorine | 9 | 10 | 9 | 19 |
| Magnesium | 12 | 12 | 12 | 24 |
| Calcium | 20 | 20 | 20 | 40 |
5. Các Lưu Ý
- Đối với các ion, số electron sẽ thay đổi so với số proton dựa trên điện tích của ion. Nếu ion mang điện tích dương, số electron sẽ giảm. Ngược lại, nếu ion mang điện tích âm, số electron sẽ tăng.
- Nguyên tử của các đồng vị cùng nguyên tố sẽ có cùng số proton nhưng số nơtron có thể khác nhau.

.png)
1. Khái niệm cơ bản về các hạt proton, nơtron, và electron
Trong nguyên tử, có ba loại hạt cơ bản cấu thành là proton, nơtron, và electron. Hiểu rõ về ba loại hạt này là nền tảng quan trọng trong việc nghiên cứu cấu trúc nguyên tử và các phản ứng hóa học. Dưới đây là mô tả chi tiết về từng loại hạt:
- Proton: Proton là hạt mang điện tích dương \((+1)\) và được tìm thấy trong hạt nhân của nguyên tử. Số lượng proton trong một nguyên tử quyết định nguyên tố hóa học của nó. Ví dụ, một nguyên tử có một proton là nguyên tố hydro, trong khi nguyên tử có sáu proton là carbon.
- Nơtron: Nơtron là hạt không mang điện, có khối lượng xấp xỉ bằng proton, và cũng được tìm thấy trong hạt nhân của nguyên tử. Nơtron đóng vai trò ổn định hạt nhân và giúp xác định khối lượng của nguyên tử. Số lượng nơtron có thể khác nhau trong các đồng vị của một nguyên tố.
- Electron: Electron là hạt mang điện tích âm \((-1)\) và quay xung quanh hạt nhân trong các lớp vỏ nguyên tử. Khối lượng của electron rất nhỏ so với proton và nơtron, nhưng chúng có vai trò quan trọng trong việc tạo thành các liên kết hóa học và xác định tính chất của nguyên tử.
Các hạt này tương tác với nhau thông qua lực điện từ và lực hạt nhân mạnh, tạo nên cấu trúc bền vững của nguyên tử. Số lượng proton, nơtron, và electron trong một nguyên tử không chỉ xác định bản chất của nguyên tử mà còn ảnh hưởng đến các tính chất hóa học và vật lý của nó.
2. Công thức và cách xác định số proton, nơtron, electron
Để xác định số lượng proton, nơtron và electron trong một nguyên tử, chúng ta có thể dựa vào các công thức và nguyên lý sau:
- Số proton (\(Z\)): Số proton trong hạt nhân của nguyên tử chính là số hiệu nguyên tử của nguyên tố đó. Ví dụ, số proton của nguyên tố carbon là 6, của oxy là 8.
- Số electron: Trong một nguyên tử trung hòa về điện, số lượng electron bằng với số lượng proton. Do đó, số electron cũng là \(Z\).
- Số nơtron (\(N\)): Số nơtron trong hạt nhân được xác định bằng cách lấy số khối (\(A\)) trừ đi số proton (\(Z\)). Công thức tính số nơtron là:
Trong đó:
- \(A\) là số khối, tức tổng số proton và nơtron trong hạt nhân.
- \(Z\) là số proton, hay số hiệu nguyên tử.
Ví dụ, nếu một nguyên tử có số khối là 23 và số proton là 11, thì số nơtron sẽ được tính như sau:
Do đó, nguyên tử này sẽ có 11 proton, 11 electron và 12 nơtron.
Việc hiểu rõ và áp dụng đúng công thức này giúp chúng ta xác định chính xác số lượng các hạt cơ bản trong nguyên tử, từ đó giúp phân tích và dự đoán các tính chất hóa học của nguyên tố.

3. Liên hệ giữa số proton, nơtron, electron trong các đồng vị
Đồng vị là các biến thể của cùng một nguyên tố hóa học, trong đó các nguyên tử có cùng số proton nhưng khác nhau về số nơtron. Điều này dẫn đến sự khác biệt về khối lượng nguyên tử giữa các đồng vị của một nguyên tố, mặc dù chúng vẫn có cùng số electron và do đó có tính chất hóa học tương tự.
- Số proton (\(Z\)): Trong tất cả các đồng vị của một nguyên tố, số proton luôn cố định và bằng với số hiệu nguyên tử của nguyên tố đó. Ví dụ, tất cả các đồng vị của carbon đều có 6 proton.
- Số nơtron (\(N\)): Số nơtron trong các đồng vị khác nhau của cùng một nguyên tố là khác nhau. Sự khác biệt này được tính toán bằng cách lấy số khối (\(A\)) của từng đồng vị trừ đi số proton (\(Z\)).
- Số electron: Vì số proton không đổi, số electron trong các đồng vị của một nguyên tố cũng không thay đổi, nếu nguyên tử ở trạng thái trung hòa.
Công thức xác định số nơtron trong các đồng vị là:
Ví dụ, carbon có ba đồng vị chính:
- Carbon-12: Có số khối là 12, với 6 proton và 6 nơtron.
- Carbon-13: Có số khối là 13, với 6 proton và 7 nơtron.
- Carbon-14: Có số khối là 14, với 6 proton và 8 nơtron.
Dù có khác biệt về số nơtron, các đồng vị này vẫn giữ nguyên số electron, do đó các đồng vị của một nguyên tố thường có tính chất hóa học tương tự nhưng có thể có tính chất vật lý khác nhau do sự khác biệt về khối lượng nguyên tử.

4. Ứng dụng của việc xác định số proton, nơtron, electron
Việc xác định số proton, nơtron, và electron trong nguyên tử có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khoa học và đời sống. Dưới đây là một số ứng dụng chính:
- Hóa học phân tích: Trong phân tích hóa học, việc biết số proton, nơtron và electron giúp xác định danh tính của nguyên tố và cấu hình electron của chúng, từ đó dự đoán tính chất hóa học và phản ứng.
- Y học hạt nhân: Trong y học hạt nhân, các đồng vị phóng xạ (radioisotope) được sử dụng để chẩn đoán và điều trị bệnh. Việc xác định số nơtron và proton là cơ sở để hiểu và sử dụng các đồng vị này an toàn và hiệu quả.
- Vật lý hạt nhân: Xác định số proton và nơtron giúp hiểu rõ cấu trúc hạt nhân, là cơ sở cho các nghiên cứu về phản ứng hạt nhân, năng lượng hạt nhân, và sự phân rã phóng xạ.
- Khảo cổ học và địa chất học: Đồng vị phóng xạ cũng được sử dụng để xác định tuổi của các vật liệu cổ xưa thông qua phương pháp định tuổi bằng carbon và các phương pháp khác. Việc xác định số proton và nơtron giúp tính toán chính xác tuổi của mẫu vật.
- Khoa học vật liệu: Số electron và proton xác định cách nguyên tử liên kết và tạo thành vật liệu. Điều này rất quan trọng trong việc phát triển vật liệu mới với các tính chất đặc biệt như dẫn điện, cách nhiệt, hay từ tính.
Việc hiểu rõ cấu trúc nguyên tử thông qua số proton, nơtron, và electron không chỉ là nền tảng của nhiều ngành khoa học mà còn có tác động trực tiếp đến các ứng dụng thực tế, từ y học, vật lý đến khoa học vật liệu.

5. Bài tập áp dụng
Để củng cố kiến thức về việc xác định số proton, nơtron và electron trong nguyên tử, dưới đây là một số bài tập áp dụng cụ thể:
-
Bài tập 1: Xác định số proton, nơtron và electron trong nguyên tử của nguyên tố Carbon-12 (\(^{12}C\)).
- Đề bài: Cho biết số khối của Carbon-12 là 12 và số nguyên tử là 6.
- Hướng dẫn giải:
- Số proton (\(Z\)) bằng số nguyên tử: \(Z = 6\).
- Số nơtron (\(N\)) bằng số khối trừ đi số proton: \(N = 12 - 6 = 6\).
- Số electron (\(e^-\)) bằng số proton (trong nguyên tử trung hòa): \(e^- = 6\).
- Kết quả: Số proton = 6, Số nơtron = 6, Số electron = 6.
-
Bài tập 2: Xác định số proton, nơtron và electron trong ion \(Na^+\) có số khối là 23.
- Đề bài: Cho biết số nguyên tử của Na là 11.
- Hướng dẫn giải:
- Số proton (\(Z\)) bằng số nguyên tử: \(Z = 11\).
- Số nơtron (\(N\)) bằng số khối trừ đi số proton: \(N = 23 - 11 = 12\).
- Số electron (\(e^-\)) trong ion \(Na^+\) bằng số proton trừ đi 1 (do mất 1 electron): \(e^- = 11 - 1 = 10\).
- Kết quả: Số proton = 11, Số nơtron = 12, Số electron = 10.
-
Bài tập 3: Xác định số proton, nơtron và electron trong nguyên tử đồng vị của Uranium-238 (\(^{238}U\)).
- Đề bài: Cho biết số khối của Uranium-238 là 238 và số nguyên tử là 92.
- Hướng dẫn giải:
- Số proton (\(Z\)) bằng số nguyên tử: \(Z = 92\).
- Số nơtron (\(N\)) bằng số khối trừ đi số proton: \(N = 238 - 92 = 146\).
- Số electron (\(e^-\)) bằng số proton (trong nguyên tử trung hòa): \(e^- = 92\).
- Kết quả: Số proton = 92, Số nơtron = 146, Số electron = 92.
Những bài tập trên giúp bạn nắm vững cách tính toán và xác định số lượng các hạt cơ bản trong nguyên tử và ion, đồng thời nâng cao kỹ năng áp dụng vào các trường hợp thực tế.
XEM THÊM:
6. Tổng kết
Hiểu rõ cách xác định số proton, nơtron, và electron không chỉ là nền tảng quan trọng trong hóa học và vật lý mà còn có ý nghĩa rộng lớn trong nhiều lĩnh vực khoa học khác. Kiến thức này cung cấp cho chúng ta công cụ để phân loại và xác định các nguyên tố, hiểu về tính chất của chúng, và dự đoán cách chúng tham gia vào các phản ứng hóa học.
- Số proton là yếu tố quyết định bản chất hóa học của một nguyên tố. Số hiệu nguyên tử \(Z\) của nguyên tố chính là số proton trong hạt nhân, xác định vị trí của nguyên tố đó trong bảng tuần hoàn và ảnh hưởng đến các tính chất vật lý và hóa học cơ bản.
- Số nơtron cùng với số proton tạo nên khối lượng nguyên tử của một nguyên tố. Việc hiểu rõ số nơtron giúp giải thích sự tồn tại của các đồng vị, những biến thể của cùng một nguyên tố với số proton không đổi nhưng số nơtron khác nhau. Công thức tính số nơtron được cho bởi: \[ N = A - Z \] trong đó \(N\) là số nơtron, \(A\) là số khối và \(Z\) là số proton.
- Số electron trong một nguyên tử trung hòa về điện tích bằng số proton. Trong các ion, số electron sẽ thay đổi tùy theo loại và mức độ ion hóa. Ví dụ, ion \(Mg^{2+}\) sẽ có 10 electron do mất đi 2 electron so với nguyên tử Mg trung hòa.
Việc nắm bắt cách tính toán số lượng và hiểu rõ vai trò của các hạt cơ bản này giúp các nhà khoa học phát triển nhiều ứng dụng thực tiễn trong các lĩnh vực như:
- Y học hạt nhân: Sử dụng các đồng vị phóng xạ trong chẩn đoán và điều trị, chẳng hạn như Iod-131 dùng trong điều trị các bệnh về tuyến giáp.
- Công nghệ vật liệu: Hiểu rõ cấu trúc nguyên tử giúp phát triển các vật liệu mới với tính chất đặc biệt, chẳng hạn như các vật liệu siêu dẫn hoặc vật liệu nano trong công nghệ cao.
- Nghiên cứu khoa học: Khả năng xác định chính xác số lượng các hạt trong nguyên tử đóng vai trò quan trọng trong nghiên cứu vật lý hạt nhân, hóa học, và nhiều ngành khoa học khác, giúp chúng ta hiểu rõ hơn về cấu trúc và hành vi của vật chất ở mức độ nguyên tử.
Tóm lại, việc xác định số proton, nơtron và electron là nền tảng quan trọng trong hóa học và vật lý, và kiến thức này có thể được áp dụng rộng rãi từ nghiên cứu khoa học cơ bản đến các ứng dụng thực tế trong nhiều lĩnh vực khác nhau.