Chủ đề cách viết ô lượng tử: Cách viết ô lượng tử là một kỹ năng quan trọng trong hóa học, giúp bạn dễ dàng biểu diễn cấu hình electron của các nguyên tử. Bài viết này sẽ cung cấp hướng dẫn chi tiết, từ các quy tắc cơ bản đến ví dụ minh họa, giúp bạn hiểu rõ và áp dụng trong các bài tập một cách hiệu quả. Hãy cùng khám phá cách viết ô lượng tử dễ hiểu nhất!
Mục lục
Cách viết ô lượng tử
Ô lượng tử là một phương pháp biểu diễn cấu hình electron của các nguyên tử hoặc ion trong hóa học. Phương pháp này sử dụng các ô vuông nhỏ để thể hiện các orbital, và mỗi electron được biểu diễn bằng một mũi tên trong ô, chỉ ra spin của electron đó.
Quy tắc Pauli
Mỗi orbital có thể chứa tối đa hai electron, với điều kiện chúng phải có spin ngược nhau. Spin của electron được biểu diễn bằng mũi tên hướng lên và mũi tên hướng xuống.
- Ký hiệu: \( \uparrow \) và \( \downarrow \)
- Nguyên tắc: Trên cùng một orbital chỉ chứa tối đa 2 electron có spin đối lập.
Quy tắc Hund
Khi phân bố electron vào các orbital có cùng năng lượng, electron sẽ được phân vào các orbital trống trước khi ghép đôi.
Ví dụ:
Cấu hình electron của oxy \( O \) (Z = 8):
- 1s: \( \uparrow \downarrow \)
- 2s: \( \uparrow \downarrow \)
- 2p: \( \uparrow \uparrow \uparrow \downarrow \)
Các bước viết ô lượng tử
- Xác định số electron của nguyên tử: Số electron bằng với số proton của nguyên tử (số hiệu nguyên tử).
- Sắp xếp các electron vào các orbital theo quy tắc Pauli và quy tắc Hund.
- Viết cấu hình electron theo ô lượng tử: Biểu diễn mỗi orbital bằng một ô vuông nhỏ, và các electron trong orbital được biểu diễn bằng các mũi tên.
Ví dụ minh họa
Xét nguyên tử carbon (C), với số hiệu nguyên tử là Z = 6. Cấu hình electron của carbon là:
\[ 1s^2 2s^2 2p^2 \]
Viết dưới dạng ô lượng tử:
- 2p: \( \uparrow \uparrow \)
Ứng dụng của ô lượng tử
Ô lượng tử giúp dễ dàng biểu diễn cấu hình electron của nguyên tử, hỗ trợ trong việc dự đoán các tính chất hóa học và khả năng liên kết của nguyên tử đó. Việc hiểu rõ cấu hình electron giúp nhà khoa học giải thích được tính chất hóa học như tính kim loại, phi kim, và tính trơ của các nguyên tố.

.png)
1. Giới thiệu về ô lượng tử
Ô lượng tử là một công cụ quan trọng trong hóa học để biểu diễn cấu hình electron của nguyên tử hoặc ion. Các ô vuông nhỏ được sử dụng để biểu diễn các orbital, mỗi ô thể hiện khả năng chứa electron theo quy tắc Pauli và quy tắc Hund.
Trong biểu diễn ô lượng tử:
- Mỗi ô vuông đại diện cho một orbital, chứa tối đa hai electron.
- Electron trong một orbital được biểu diễn bằng mũi tên, chỉ ra spin của electron. Mũi tên hướng lên (↑) biểu diễn spin dương, và mũi tên hướng xuống (↓) biểu diễn spin âm.
Các bước cơ bản để viết ô lượng tử:
- Xác định số electron của nguyên tử dựa trên số hiệu nguyên tử.
- Điền các electron vào các orbital theo quy tắc vững bền, bắt đầu từ orbital có mức năng lượng thấp nhất.
- Tuân thủ quy tắc Hund khi điền electron vào các orbital có cùng mức năng lượng: electron sẽ được điền vào các orbital trống trước khi ghép đôi.
Ví dụ, đối với nguyên tử oxy với số electron là 8, ô lượng tử sẽ được viết như sau:
- 1s: \(\uparrow \downarrow\)
- 2s: \(\uparrow \downarrow\)
- 2p: \(\uparrow \uparrow \downarrow\)
Ô lượng tử giúp minh họa cấu trúc electron một cách trực quan, hỗ trợ trong việc hiểu rõ tính chất hóa học của các nguyên tử và dự đoán khả năng phản ứng của chúng.
2. Cấu trúc electron trong ô lượng tử
Cấu trúc electron trong ô lượng tử giúp hiểu rõ cách sắp xếp và phân bố electron trong các orbital của nguyên tử. Nguyên lý cơ bản là electron luôn chiếm các orbital có năng lượng thấp trước khi di chuyển lên các orbital có năng lượng cao hơn. Điều này tuân theo quy tắc Aufbau và nguyên lý Pauli.
Mỗi orbital trong một phân lớp có thể chứa tối đa 2 electron với spin ngược chiều, được biểu diễn trong một ô lượng tử. Các electron sẽ điền vào các orbital theo nguyên tắc Hund, nghĩa là các orbital có cùng mức năng lượng sẽ được điền riêng lẻ trước khi bắt đầu cặp đôi. Điều này tạo ra cấu hình electron ổn định hơn cho các nguyên tử.
Ví dụ, đối với nguyên tử Oxy (\( Z=8 \)), cấu hình electron sẽ là:
\[
1s^2 2s^2 2p^4
\]
Các electron sẽ lần lượt chiếm các phân lớp từ năng lượng thấp đến cao: phân lớp 1s chứa 2 electron, phân lớp 2s chứa 2 electron và phân lớp 2p chứa 4 electron.
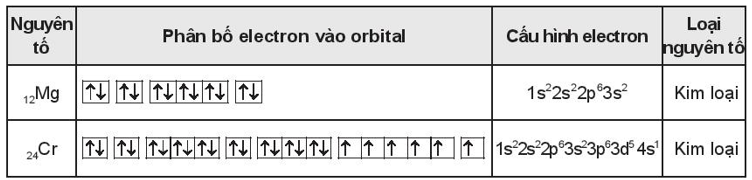
Tương tự, đối với nguyên tử Magie (\( Z=12 \)) và Crom (\( Z=24 \)), cấu hình electron lần lượt là:
\[
\text{Mg}: 1s^2 2s^2 2p^6 3s^2
\]
\[
\text{Cr}: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5
\]
Lưu ý, Crom có một cấu hình đặc biệt do sự ổn định của các orbital d bán đầy.

3. Ứng dụng thực tiễn của ô lượng tử
Ô lượng tử đã tạo ra những đột phá lớn trong nhiều lĩnh vực khoa học và công nghệ. Trong công nghệ bán dẫn, ô lượng tử được ứng dụng để phát triển các loại diode tunnel và vi mạch tích hợp, giúp nâng cao hiệu suất thiết bị điện tử. Trong y tế, các hệ thống lượng tử hỗ trợ mô phỏng cấu trúc phân tử, từ đó đẩy nhanh việc phát triển thuốc mới. Đồng thời, ô lượng tử còn được ứng dụng rộng rãi trong kính hiển vi quét chui hầm (STM) để nghiên cứu cấu trúc vật liệu ở mức độ nguyên tử.
- Công nghệ bán dẫn: Diode tunnel và vi mạch tích hợp
- Y tế: Hỗ trợ nghiên cứu và phát triển thuốc
- Vật liệu học: Kính hiển vi quét chui hầm (STM)
4. Bài tập ô lượng tử
Ô lượng tử là một phương pháp biểu diễn cấu hình electron bằng các ô vuông nhỏ để mô tả sự phân bố và trạng thái của các electron trong nguyên tử. Bài tập về ô lượng tử thường yêu cầu học sinh viết cấu hình electron của các nguyên tố, dựa trên số electron và quy tắc Hund, Pauli.
- Ví dụ 1: Viết cấu hình electron cho nguyên tử carbon (C, Z=6). Sử dụng quy tắc Hund để điền các electron vào các ô lượng tử của phân lớp 2p.
- Ví dụ 2: Viết cấu hình ô lượng tử cho nguyên tử oxy (O, Z=8), áp dụng quy tắc Pauli và quy tắc Aufbau.
Các bước giải bài tập ô lượng tử:
- Xác định số electron của nguyên tử cần viết.
- Sắp xếp electron vào các phân lớp theo thứ tự năng lượng.
- Điền electron vào các orbital tuân theo quy tắc Hund và Pauli.
- Kiểm tra lại cấu hình và biểu diễn dưới dạng ô lượng tử.
Thông qua việc giải bài tập ô lượng tử, học sinh không chỉ nắm rõ cấu trúc của nguyên tử mà còn hiểu sâu hơn về tính chất hóa học của các nguyên tố.

5. Kết luận
Ô lượng tử là một công cụ quan trọng trong việc mô tả cấu trúc electron của nguyên tử và phân tử. Việc nắm vững cách viết ô lượng tử giúp học sinh hiểu rõ hơn về các nguyên lý cơ bản trong hóa học và vật lý. Bằng cách áp dụng các quy tắc như Aufbau, Pauli và Hund, học sinh có thể dễ dàng sắp xếp electron vào các orbital và dự đoán cấu hình ổn định của nguyên tử. Việc thực hành thông qua các bài tập cũng giúp củng cố kiến thức và khả năng ứng dụng của ô lượng tử vào các lĩnh vực khác nhau trong khoa học.





















